
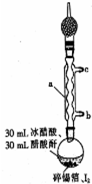
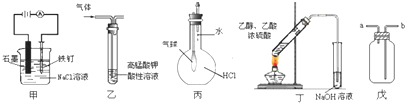
 四碘化锡是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:
四碘化锡是一种橙红色结晶,熔点为144.5℃,沸点为364℃,不溶于冷水,溶于醇、苯、氯仿等,遇水易水解,常用作分析试剂和有机合成试剂.实验室制备四碘化锡的主要步骤如下:分析 (1)根据仪器形状确定名称,冷凝水下进上出;
(2)装有无水CaCl2的干燥管可吸收空气中的水蒸气,锡箔需剪碎增大与I2的接触面;醋酸酐能与水反应;
(3)锡与碘反应生成四碘化锡,单质碘过量可使锡反应完全;
(4)碘蒸气为紫红色;
(5)醋酸易溶于氯仿.
解答 解:(1)仪器a的名称为冷凝管,冷凝水下进上出;从b进入,故答案为:冷凝管;b;
(2)装有无水CaCl2的干燥管可吸收空气中的水蒸气,防止空气中水蒸气进入反应器中;锡箔需剪碎增大与I2的接触面;醋酸酐能与水反应,防止四碘化锡水解,故答案为:防止空气中水蒸气进入反应器中;增大与I2的接触面,加快反应速率;除去体系中的水,防止四碘化锡水解;
(3)锡与碘反应生成四碘化锡,Sn+2I2$\frac{\underline{\;\;△\;\;}}{\;}$SnI4,单质碘过量可使锡反应完全,故答案为:Sn+2I2$\frac{\underline{\;\;△\;\;}}{\;}$SnI4;防止锡屑混入四碘化锡晶体中;
(4)紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色,溶液中生成四碘化锡为橙红色,故答案为:紫红色的碘蒸气消失,溶液颜色由紫红色变成橙红色;
(5)醋酸易溶于氯仿,除掉在职,提纯SnI4产品,故答案为:提纯SnI4产品.
点评 本题考查物质的分离、提纯,侧重于学生的分析能力、实验能力和评价能力的考查,难度不大,注意把握物质的性质的异同,注意除杂时不能引入新的杂质.


科目:高中化学 来源: 题型:解答题
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.836 | 5.672 | 8.508 |
| 生成气体的体积(标准状况)/L | 1.12 | 2.24 | 2.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
下图曲线a表示反应X(g)+Y(g)+N(s)?Z(g)+M(g)△H<0进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大N的投入量 | C. | 添加催化剂 | D. | 加大X的投入量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3→Al(OH)3 | B. | Na→Na2O2 | C. | Fe(OH)2→Fe(OH)3 | D. | Al(OH)3→AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

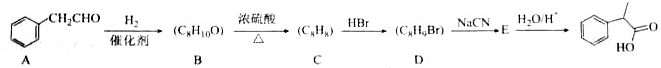
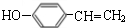 .
.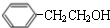 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$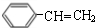 +H2O;C→D的反应类型为加成反应
+H2O;C→D的反应类型为加成反应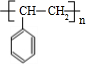 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲、乙、丙、丁 | B. | 丙、丁、乙、甲 | C. | 丙、丁、甲、乙 | D. | 丁、丙、乙、甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②③ | C. | ③⑤ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.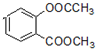 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.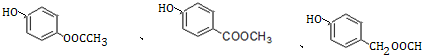 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com