
分析 (1)依据m=CVM计算溶质的质量;
(2)①根据配制一定物质的量浓度溶液的实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
②实验失败不能挽救的必须重新配制;
③定容时后,倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,导致溶液的体积偏大;
(3)A.为防止漏水,使用容量瓶前要检查它是否漏水;
B.容量瓶为精密仪器,不能用来溶解固体;
C.为使溶液混合均匀,定容后需要把容量瓶倒转反复上下摇匀,依据摇匀的正确操作解答.
解答 解:(1)配制250mL 0.2mol/L的NaOH溶液,需要氢氧化钠固体质量=0.2mol/L×0.25 L×40g/mol=2.0g;
故答案为:2.0g;
(2)①配制一定物质的量浓度溶液的实验操作的步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等操作,用到的仪器有:托盘天平、药匙、烧杯、玻璃棒、520ml容量瓶、胶头滴管,所以还缺少的仪器是:
250mL容量瓶、胶头滴管;
故答案为:250mL容量瓶;胶头滴管;
②定容时,如果加水超过刻度线,导致实验失败且不能挽救,必须重新配制;
故答案为:重新配制;
③定容时后,倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度,导致溶液的体积偏大,依据C=$\frac{n}{V}$可知,溶液浓度偏低;
故答案为:偏低;
(3)A.使用容量瓶前要检查它是否漏水,防止在配制溶液过程中漏液,故A正确;
B.配制溶液时,要先溶解稀释,冷却至室温以后,再转移至容量瓶,不能用容量瓶溶解固体,故B错误;
C.摇匀时食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转反复上下摇匀,故C正确;
故选:B.
点评 本题考查了用容量瓶配制一定物质的量浓度溶液的实验操作和注意事项,熟悉配制原理及容量瓶的构造和使用注意事项是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
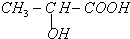 ,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
,现以A为主要原料合成乙酸乙酯,其合成路线如图所示.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2OH+HBr$→_{H+}^{△}$CH3CH2CH2Br+H2O | |
| B. |  +NaHCO3→ +NaHCO3→ +H2CO3 +H2CO3 | |
| C. |  +CO2+H2O→ +CO2+H2O→ +NaHCO3 +NaHCO3 | |
| D. |  +3Br2→ +3Br2→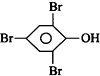 ↓+3HBr ↓+3HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、麦芽糖互为同分异构体 | |
| B. | 常用蛋白质的颜色反应来鉴别部分蛋白质 | |
| C. | 用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 | |
| D. | 油脂在酸性或碱性条件下均能发生水解反应,且产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

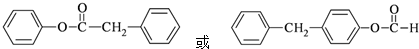 .
. $→_{Pd/C}^{H_{2}}$
$→_{Pd/C}^{H_{2}}$ .化合物
.化合物  是合成抗癌药物美发伦的中间体,请写出以
是合成抗癌药物美发伦的中间体,请写出以  和
和 为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,14.0g乙烯和丁烯的混合气体中含有的C-H键数目为2NA | |
| B. | 2molSO2和1molO2在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 2.3g金属钠与过量的氧气反应,无论是否加热,转移的电子数均为0.1NA | |
| D. | 1mol Na2CO3晶体中含有的CO32-离子数小于NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com