
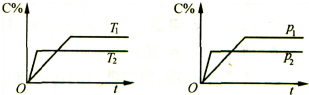
| A. | Tl>T2,△H<O | B. | Tl<T2,△H<O | C. | Pl>P2,a+b>c | D. | Pl<P2,a+b>c |
分析 由图可知,压强P2先到达平衡,则压强P2>P1,压强越大,C的百分含量减小,说明增大压强平衡向逆反应方向移动;温度T1先到达平衡,故温度T1<T2,温度越高,平衡时C的含量越低,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应,据此分析解答.
解答 解:由图可知,压强P2先到达平衡,则压强P2>P1,压强越大,C的百分含量减小,说明增大压强平衡向逆反应方向移动,所以逆方向是气体的系数和减小的方向,a+b<c;温度T1先到达平衡,故温度T1<T2,温度越高,平衡时C的含量越低,说明升高温度平衡向逆反应方向移动,该反应的正反应为放热反应△H<O,故选B.
点评 本题考查化学平衡图象及影响因素,难度中等,注意采取控制变量法与“先拐先平数值大”原则分析解答.


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打NaHCO3 | B. | 烧碱NaOH | C. | 绿矾FeSO4•7H2O | D. | 钡餐BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
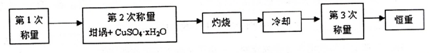

| 加热前质量 | 加热后质量 | ||
| m1 | m2 | m3 | m4 |
| 11.721g | 22.692g | 18.631g | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 惰性电极电解硝酸银溶液不可能在电极上生成银,因为银可以溶于硝酸 | |
| B. | 25℃,惰性电极电解氢氧化钠溶液,溶液PH不变,因为实质是电解水 | |
| C. | 惰性电极电解足量硫酸铜溶液一段时间加入氧化铜固体可使电解质恢复到电解前 | |
| D. | 惰性电极电解淀粉碘化钾溶液,可看到阴极区域溶液变蓝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向AlCl3溶液中滴加氨水,会产生白色沉淀,再加入NaHSO4,沉淀不消失 | |
| B. | 浓的NaOH溶液不慎溅到皮肤上,可无用大量水冲洗,再涂上硼酸或稀醋酸溶液 | |
| C. | AlCl3溶液中加入过量NaF固体,再滴加氨水,无沉淀产生说明[AlF6]3-很难电离 | |
| D. | 检验Cl-时,为了排除SO42-的干扰,可先滴加过量的Ba(NO3)2溶液后,取上层溶液,再滴加AgNO3溶液,若有白色沉淀,则表明原溶液中有Cl-存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每转移0.1mol电子,理论上生成20.7g Pb | |
| B. | 常温时,在正负极间接上电流表或检流计,指针不偏转 | |
| C. | 正极反应式:Pb2++2e-═Pb | |
| D. | 放电过程中,Li+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
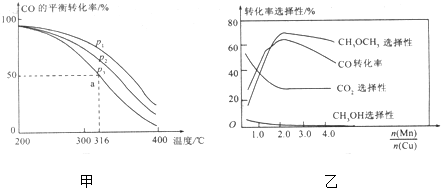
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com