
| A、Na2S2O3在反应中被还原为Na2SO4 |
| B、0.1mol Na2S2O3在反应中转移0.4mol电子 |
| C、反应中的未知物的系数均为11 |
| D、还原性LiCoO2大于CoSO4 |


科目:高中化学 来源: 题型:
| A、2a2=a1=197 kJ |
| B、197 kJ>a1=2a2 |
| C、a2>a1>197 kJ |
| D、2a2<a1<197 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCl和HCN都易形成白雾 |
| B、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
| C、NaCN和AgCN都易溶于水 |
| D、MnO2可与浓HCN溶液反应生成(CN)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应是旧键断裂和新键形成的过程 |
| B、盖斯定律实质上是能量守恒定律的体现 |
| C、反应前后分子数不变遵循的是质量守恒定律 |
| D、溶解平衡、水解平衡和电离平衡均为动态平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 |
| B、15℃时氨基甲酸铵的分解平衡常数为2.048×10-9(mol/L)3 |
| C、恒温下压缩体积,NH3的体积分数减小 |
| D、再加入一定量氨基甲酸铵,可加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol甲醇中含有C-H键的数目为4NA |
| B、25℃.pH=13的NaOH溶液中含有OH?的数目为0.1NA |
| C、标准状况下,2.24 L己烷含有分子的数目为0.1NA |
| D、常温常压下,0.4mol Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、80mL | B、100mL |
| C、150mL | D、145mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
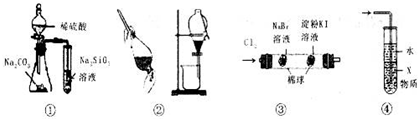
| A、图①所示实验,能比较硫、碳、硅三种元素的非金属性强弱 |
| B、装置②可用于从溴水中提取单质溴 |
| C、装置③中,左边棉花变为橙色,右边棉花变为蓝色,证明氧化性:Cl2>Br2>I2 |
| D、装置④中,X若为CCl4,可用吸收NH3或HCl,并防止倒吸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com