设NA代表阿伏伽德罗常数的数值,下列说法正确的是( )
A.32gO3与NA个O2所含的氧原子数不同
B.NA个一氧化碳分子和0.5mol甲烷的质量比为7:2
C.46gNO2和46gN2O4含有的原子数之和为3NA
D.2.4g金属镁与足量的盐酸反应,生成氢气的分子数为NA
【答案】
分析:A、N
A个O
2所含的氧原子数为2N
A个,根据n=

,32gO
3中氧原子的物质的量,再根据N=nN
A计算氧原子数目,据此判断.
B、N
A个一氧化碳分子物质的量为1mol,根据m=nM计算质量,进行判断.
C、二氧化氮与四氧化二氮气体中氮元素的质量分数为

,氧元素的质量分数为
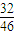
,计算氮元素与氧元素的质量,根据n=

计算氮原子与氧原子物质的量,结合根据N=nN
A计算原子数目.
D、2.4g金属镁与足量的盐酸反应,生成氢气0.1mol,根据N=nN
A计算氢气分子数目.
解答:解:A、N
A个O
2所含的氧原子数为2N
A个,32gO
3中氧原子的物质的量为
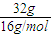
=2mol,所以32gO
3中含有氧原子数目为
2mol×N
Amol
-1=2N
A,二者相等,故A错误;
B、N
A个一氧化碳分子的物质的量为1mol,质量为28g,0.5mol甲烷的质量为0.5mol×16g/mol=8g,所以二者质量之比为
28:8=7:2,故B正确;
C、二氧化氮与四氧化二氮的最简式相同,所以气体中氮元素的质量分数为
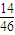
,氧元素的质量分数为
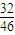
,
故46gNO
2和46gN
2O
4气体中氮元素质量为92g×

=28g,氮原子的物质的量为2mol,氧元素的质量为92g×
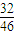
=64g,所以氧原子的物质的量为4mol,故46gNO
2和46gN
2O
4含有的原子总数为(2mol+4mol)×N
Amol
-1=6N
A,故C错误;
D、根据Mg+2HCl=MgCl
2+H
2↑可知,2.4g金属镁与足量的盐酸反应,生成氢气0.1mol,氢气的分子数为0.1N
A,故D错误.
故选:B.
点评:考查常用化学计量的有关计算,难度中等,C选项中存在平衡2NO
2?N
2O
4,注意分子数的计算.

 ,32gO3中氧原子的物质的量,再根据N=nNA计算氧原子数目,据此判断.
,32gO3中氧原子的物质的量,再根据N=nNA计算氧原子数目,据此判断. ,氧元素的质量分数为
,氧元素的质量分数为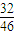 ,计算氮元素与氧元素的质量,根据n=
,计算氮元素与氧元素的质量,根据n= 计算氮原子与氧原子物质的量,结合根据N=nNA计算原子数目.
计算氮原子与氧原子物质的量,结合根据N=nNA计算原子数目.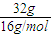 =2mol,所以32gO3中含有氧原子数目为
=2mol,所以32gO3中含有氧原子数目为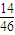 ,氧元素的质量分数为
,氧元素的质量分数为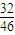 ,
, =28g,氮原子的物质的量为2mol,氧元素的质量为92g×
=28g,氮原子的物质的量为2mol,氧元素的质量为92g×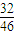 =64g,所以氧原子的物质的量为4mol,故46gNO2和46gN2O4含有的原子总数为(2mol+4mol)×NAmol-1=6NA,故C错误;
=64g,所以氧原子的物质的量为4mol,故46gNO2和46gN2O4含有的原子总数为(2mol+4mol)×NAmol-1=6NA,故C错误;

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案