
【题目】下列说法正确的是
A. 向0.1 mol·L1的氨水中加少量硫酸铵固体,则溶液中![]() 增大
增大
B. 常温下,0.1 mol·L1一元酸(HA)溶液pH=3,则该溶液中,c2(H+)=c(H+)×c(A)+KW
C. 向含有1 mol KAl(SO4)2的溶液中加入Ba(OH)2溶液得到沉淀的物质的量最多为 2 mol
D. 将Ca(ClO)2、Na2SO3、FeCl3、NaAlO2溶液蒸干均得不到原溶质
科目:高中化学 来源: 题型:
【题目】如图装置可以用来发生、洗涤、干燥、收集(不考虑尾气处理)气体。该装置可用于( )

A.锌和盐酸生成氢气
B.氯酸钾和二氧化锰生成氧气
C.碳酸钙和盐酸生成二氧化碳
D.氯化钠和浓硫酸生成氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组的学生在实验室用二氧化锰和浓盐酸反应来制取氯气,装置如图:

(1)写出实验室制取氯气的化学反应方程式___。
(2)为了除去氯气中的少量氯化氢气体,可以在收集氯气之前,让氯气经过___(填试剂序号)。为吸收残余氯气,可在烧杯中加入___(填试剂序号)。其化学方程式是___。
A.水 B.浓硫酸 C.饱和食盐水 D.烧碱溶液
(3)兴趣小组成员甲同学认为,此反应装置还可以用来制取___(填编号)。
A.氧气 B.氢气 C.二氧化碳 D.氯化氢
但是,成员乙同学认为,要用整套装置来制取甲同学提出的气体,必须改进其中的___(填编号),理由是___。
A.气体的发生装置 B.气体的收集装置 C.尾气吸收装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构.请回答下列问题.
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:

则,A的化合价__B的化合价(填“>”、“<”或“=”).
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:

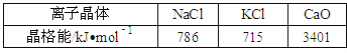
则该 4种离子晶体(不包括NaCl)熔点从高到低的顺序是:__.
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是___________________________.
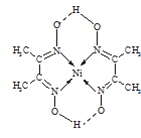
(4)某配合物的分子结构如图所示,则N原子的杂化方式为__;基态Ni原子的电子排布式__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的四种主族元素A,B,C,D分别处于第一至第四周期,其中A元素原子核是一个质子;B元素原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D原子外围电子排布为3d104s1。请回答下列问题:
(1)这四种元素中电负性最大的是________(填元素符号),第一电离能最小的是________(填元素符号)。
(2)C所在的主族元素气态氢化物中,沸点最低的是________(填化学式)。
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图所示,其原子的杂化类型为________杂化。

(4)D的水合醋酸盐晶体局部结构如图所示,该晶体中含有的化学键是________(填选项序号)。

①极性键 ②非极性键 ③配位键 ④金属键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列事实中,各是什么因素影响了化学反应的速率。
(1)黄铁矿煅烧时要粉碎成细小颗粒______________;
(2)夏天的食品变霉,在冬天不易发生该现象_____________;
(3)同浓度同体积的盐酸中放入同样大小的锌粒和镁块,产生气体快慢程度不同__;
(4)同样大小的石灰石分别在0.1 mol·L-1的盐酸和1 mol·L-1的盐酸中反应速度不同_____________;
(5)熔化的KClO3放出气泡很慢,撒入MnO2少量很快产生气体__________;
(6)如下图,铁在海水中的腐蚀速度是②比①快______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是:_____(填元素符号),原子结构示意图为_____ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是_______,碱性最强的化合物的电子式是:_____________。
(3)用电子式表示元素④与⑥的化合物的形成过程:________,该化合物属于_____(填 “共价”或“离子”)化合物。
(4)表示①与H的化合物的化学式_________________,该化合物是由____________(填“极性”“非极性”)键形成的。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分析中正确的是( )
A. 含有碳元素的化合物不一定是烃
B. 正丁烷分子中四个碳原子可能在同一直线上
C. 常温常压下 是气态
是气态
D. 烷烃在任何情况下均不与强酸、强碱、氧化剂反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了甲烷燃料电池并探究某些工业电解原理(如图所示),其中乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),丙装置为探究粗铜精炼原理。请回答下列问题:

(1)从 a口通入的气体为_______。
(2)B电极的电极材料是________。
(3)写出甲中通甲烷一极的电极反应式:________________________________ 。
(4)写出乙中发生的总反应的离子方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com