
| A. | C6H6(l)+7.5O2(g)→6CO2(g)+3H2O(l)+41.8kJ | |
| B. | C6H6(l)+7.5O2(g)→6CO2(g)+3H2O(l)+3260.4kJ | |
| C. | 2C6H6(l)+15O2(g)→12CO2(g)+6H2O(l)+41.8kJ | |
| D. | 2C6H6(l)+15O2(g)→12CO2(g)+6H2O(l)+3260.4kJ |
分析 1g苯(C6H6,液态)完全燃烧时生成二氧化碳和液态水,放出41.8kJ的热量,从而可以计算出1mol苯燃烧放出的热量,根据热化学方程式的书写方法写出,注意物质聚集状态标注,焓变的正负.
解答 解:1克液态苯(C6H6)物质的量═$\frac{1g}{78g/mol}$=$\frac{1}{78}$mol,当完全燃烧生成液态水和CO2,放出41.8KJ的热量,故1mol苯燃烧放出热量=41.8KJ×78=3260.4KJ;
故苯燃烧的反应的热化学方程式为:C6H6(l)+$\frac{15}{2}$O2(g)→6CO2(g)+3H2O(l)+3260.4KJ或2C6H6(l)+15O2(g)→12CO2(g)+6H2O(l)+6520.8KJ,
故选B.
点评 本题考查反应热的计算,题目难度不大,注意热化学方程式的书写应标注物质的状态,并使反应热和反应物的物质的量成正比.


科目:高中化学 来源: 题型:实验题
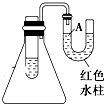 如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:
如图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应.将镁片加入小试管内,然后注入足量的盐酸,请根据要求完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
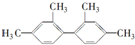 的烃,下列说法中正确的是( )
的烃,下列说法中正确的是( )| A. | 该烃苯环上的一氯取代物最多有4种 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 分子中至少有16个碳原子处于同一平面上 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
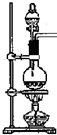
| A. | 利用浓硫酸的吸水性和氧化性 | |
| B. | 开始制备气体时应先加热后向烧瓶中加硫酸 | |
| C. | 利用浓硫酸的难挥发性和酸性 | |
| D. | 组装完实验装置立即加试剂、加热制气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对因胃酸过多而导致胃部严重溃疡的病人不可使用含有碳酸氢钠的药物治疗 | |
| B. | 淀粉、纤维素水解的最终产物都是葡萄糖 | |
| C. | 误食了重金属离子,应立即喝大量牛奶来缓解毒性 | |
| D. | R表示非处方药,OTC表示处方药 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
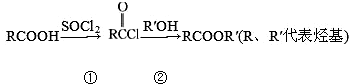 ,①②两步的产率均可达到90%以上,而RCOOH直接转化为RCOOR′产率在 60%左右,则下列说法不正确的是( )
,①②两步的产率均可达到90%以上,而RCOOH直接转化为RCOOR′产率在 60%左右,则下列说法不正确的是( )| A. | ①②两步均为取代反应 | |
| B. | ①②总产率比羧酸直接与醇反应产率高 | |
| C. | SOCl2若与足量羧酸反应产物除了 外,还有硫酸 外,还有硫酸 | |
| D. | SOCl2可以和水反应,故①反应不能用醋酸水溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com