
【题目】含铬(+6价)废水严重危害人体健康,工业上常用还原法进行处理。其部分工艺流程如下:
(1)废水中,六价铬以CrO42-;或者Cr2O72-的形式存在,写出其相互转化的离子方程式______。我国常用NaHSO3做还原剂,写出还原池中反应的离子方程式__________。
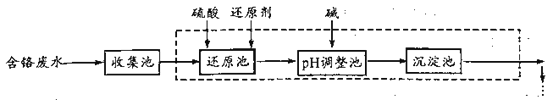
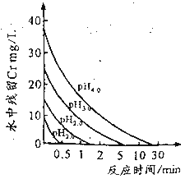
(2)废水中残留六价铬的浓度随溶液pH变化如图所示。实际生产中需控制pH=2.5~3.0,原因可能是_____________。
(3)沉淀池中生成Cr(OH)3的颗粒太细,为促使其更好地沉淀,可采取的措施是________。
(4)我国规定,工业废水中含Cr(VI)量的排放标准为0.1 mg/L。已知:Cr的相对原子质量为52,Kap(BaCrO4)=1.2×10-10。若用Ba2+除去废水中的CrO42-,达到废水排放标准时,废水中Ba2+浓度最低为___________mol/L(保留小数点后2位)。用Ba2+除去废水中的CrO42-是否可行,为什么?请简要回答。________________
【答案】2CrO42-+2H+![]() Cr2O72-+H2O 3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O 溶液中pH越高,废水中六价铬残留越多;溶液中pH越低,会腐蚀设备管道 加入絮凝剂 6.24×10-5 mol/L 不可行,因为废水中含有Ba2+,同样有毒
Cr2O72-+H2O 3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O 溶液中pH越高,废水中六价铬残留越多;溶液中pH越低,会腐蚀设备管道 加入絮凝剂 6.24×10-5 mol/L 不可行,因为废水中含有Ba2+,同样有毒
【解析】
(1)由工艺流程可知,加酸可以使CrO42-转化为Cr2O72-,还原池中,Cr2O72-在酸性条件下将HSO3—氧化生成SO42-,本身被还原为Cr3+;
(2)由图可知,溶液中pH越大废水中残留六价铬的浓度越大,而溶液中pH越小,酸性越强,可能会腐蚀设备管道;
(3)沉淀池中生成Cr(OH)3的颗粒太细,可向沉淀池中加入絮凝剂;
(4)由溶度积计算可得;Ba2+在溶液中有毒。
(1)由工艺流程可知,加酸可以使CrO42-转化为Cr2O72-,转化的离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;还原池中,Cr2O72-在酸性条件下将HSO3—氧化生成SO42-,本身被还原为Cr3+,反应的离子方程式为3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O,故答案为:2CrO42-+2H+
Cr2O72-+H2O;还原池中,Cr2O72-在酸性条件下将HSO3—氧化生成SO42-,本身被还原为Cr3+,反应的离子方程式为3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O,故答案为:2CrO42-+2H+![]() Cr2O72-+H2O;3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O;
Cr2O72-+H2O;3HSO3—+Cr2O72-+5H+=2Cr3++3SO42-+4H2O;
(2)由图可知,溶液中pH越大废水中残留六价铬的浓度越大,而溶液中pH越小,酸性越强,可能会腐蚀设备管道,所以实际生产中需控制pH=2.5~3.0,故答案为:溶液中pH越高,废水中六价铬残留越多;溶液中pH越低,会腐蚀设备管道;
(3)沉淀池中生成Cr(OH)3的颗粒太细,可向沉淀池中加入絮凝剂,使Cr(OH)3更好地沉淀,故答案为:加入絮凝剂;
(4)达到废水排放标准时,CrO42-的浓度为![]() =
=![]() mol/L,则溶液中Ba2+浓度为
mol/L,则溶液中Ba2+浓度为![]() =
=![]() =6.24×10-5 mol/L;Ba2+在溶液中有毒,则用Ba2+除去废水中的CrO42-是不可行的,故答案为:6.24×10-5 mol/L;不可行,因为废水中含有Ba2+,同样有毒。
=6.24×10-5 mol/L;Ba2+在溶液中有毒,则用Ba2+除去废水中的CrO42-是不可行的,故答案为:6.24×10-5 mol/L;不可行,因为废水中含有Ba2+,同样有毒。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】已知Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
2CrO42-(黄色)+2H+,进行以下实验,记录实验结果,并思考改变物质浓度对平衡移动的影响。
实验1:向试管中加入4mL 0.1mol·L-1 K2Cr2O7溶液,再加数滴1mol·L-1 NaOH溶液,观察溶液颜色变化;
实验2:将上述溶液分成两份向其中一份中滴加1mol·L-1 HNO3,观察溶液颜色变化,并和另一份做对比_____。
实验现象 | 实验结论 | |
实验1 | ||
实验2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
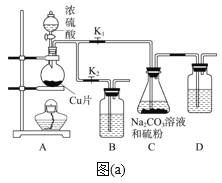
【题目】硫代硫酸钠(Na2S2O3·5H2O)俗称“海波”,应用非常广泛。工业上可以用亚硫酸钠法(亚硫酸钠和硫粉通过化合反应)制得,装置如图(a)所示。
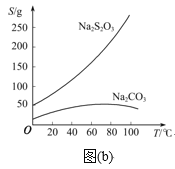
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图(b)所示。
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后,检查A、C装置气密性的操作是_____。
步骤2:加入药品,打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热。装置B、D的作用是________。
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。当C中溶液的pH接近7时,打开K2、关闭K1并停止加热;C中溶液要控制pH的理由是_____。
步骤4:过滤C中的混合液,将滤液经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:
向足量的新制氯水中滴加Na2S2O3溶液,氯水颜色变浅,再向溶液中滴加硝酸银溶液,观察到有白色沉淀产生,据此认为Na2S2O3具有还原性。该方案是否正确并说明理由:____。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL。部分反应的离子方程式为:a.Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;b.I2+2S2O32-=2I-+S4O62-。则该废水中Ba2+的物质的量浓度为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1 mol·L1 KOH溶液滴定10 mL 0.1 mol·L1 HA(Ka=1.0×105)溶液的滴定曲线如图所示。下列说法错误的是
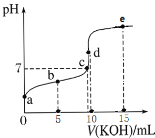
A.a点溶液的pH约为3
B.水的电离程度:d点>c点
C.b点溶液中粒子浓度大小:c(A-)>c(K+)>c(HA)>c(H+)>c(OH-)
D.e点溶液中:c(K+)=2c(A-)+2c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸厂产生的烧渣(主要含![]() 、
、![]() 及少量
及少量![]() )可用于制备
)可用于制备![]() 和还原铁粉,其流程如图:
和还原铁粉,其流程如图:

(1)“酸溶”前需粉碎烧渣,其目的是_________、________。
(2)“滤渣”的主要成分是_________(填化学式)。
(3)“还原”时,![]() 被氧化为
被氧化为![]() 的离子方程式是_________。
的离子方程式是_________。
(4)“焙烧”时,烧渣、无烟煤、![]() 的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):
的投料质量比为100∶40∶10,温度控制在1000℃(温度对焙烧炉气含量的影响变化如图所示):

添加![]() 的目的是:①脱除
的目的是:①脱除![]() 等;②_________。
等;②_________。
(5)“焙烧”在半封闭装置中进行,投料层表面盖有适当厚度的煤层,“焙烧”时间控制在4~4.5小时(焙烧时间对还原铁粉产率的影响如图所示),超过5小时后还原铁粉产率降低的原因是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天门冬氨酸锌是一种补锌剂,可以用![]() 、天门冬氨酸为原料制备。
、天门冬氨酸为原料制备。
(1)![]() 基态核外电子排布式为_______。
基态核外电子排布式为_______。
(2)![]() 的空间构型为________(用文字描述);与
的空间构型为________(用文字描述);与![]() 互为等电子体的一种阳离子的化学式为________。
互为等电子体的一种阳离子的化学式为________。
(3)天门冬氨酸( )分子中氮原子的轨道杂化类型为________;天门冬氨酸_______(填“难溶”或“易溶”)于
)分子中氮原子的轨道杂化类型为________;天门冬氨酸_______(填“难溶”或“易溶”)于![]() 盐酸。
盐酸。
(4)ZnO的晶胞结构如图所示,![]() 的配位数为________。
的配位数为________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5。下列说法不正确的是
A.浓度均为0.1mol·L-1的HCOONa和CH3COONa溶液中离子的物质的量浓度之和:前者大于后者
B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积:前者小于后者
C.0.2mol·L-1 HCOOH与0.1mol·L-1 NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+)
D.0.2mol·L-1 CH3COONa 与 0.1mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl- )>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
【沉淀制备】取一定量胆矾(CuSO4·5H2O)溶于水,再滴几滴稀硫酸,充分搅拌后得到一定体积的CuSO4溶液。向其中加适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是________。
(2)用无水乙醇洗涤的目的是________。
【实验探究】同学们设计了如下装置,用制得的蓝绿色固体进行实验:
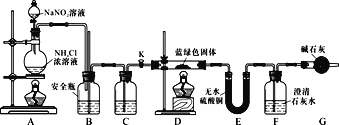
(3)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生的N2将装置中的空气排除,避免干扰。C中盛装的试剂应是________。
(4)装置A中发生反应的离子方程式为________。
(5)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是________。
(6)同学们查阅文献知:Ksp(CaCO3)=2.8×10-9,Ksp(BaCO3)=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是________。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是________。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com