
| A. | 0.1mol/L醋酸钙溶液中,c (Ca 2+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 体积和pH 都相同的NH4Cl溶液、盐酸,完全溶解少量且等同的锌粉,前者用时少 | |
| C. | 将nmolH2(g)、nmol I2(g)和2nmolH2(g)、2nmolI2(g)分别充入两个恒温恒容的容器中,平衡时H2的转化率前者小于后者 | |
| D. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,该溶液的pH一定为14-a |
分析 A.0.1mol/L醋酸钙溶液中醋酸根离子水解溶液显碱性,醋酸根离子浓度大于钙离子浓度;
B.氯化铵溶液中铵根离子水解溶液显酸性,加入少量锌粉反应,又水解生成氢离子,反应过程中溶液中氢离子浓度始终大于盐酸溶液中氢离子浓度;
C.将nmolH2(g)、nmol I2(g)和2nmolH2(g)、2nmolI2(g)分别充入两个恒温恒容的容器中,反应前后气体体积不变,达到相同平衡状态;
D.依据温度不确定,水的离子积不一定分析;
解答 解:A.0.1mol/L醋酸钙溶液中醋酸根离子水解溶液显碱性,醋酸根离子浓度大于钙离子浓度,溶液中离子浓度大小为:c(CH3COO-)>c (Ca 2+)>c(OH-)>c(H+),故A错误;
B.NH4+属于弱碱阳离子,在水溶液中存在:NH4++H2O?NH3•H2O+H+,故等体积、等pH的NH4Cl溶液和盐酸,完全溶解少量且等同的镁粉,前者产生的H+浓度大于后者,故反应速率快用时少,故B正确;
C.由于发生反应:H2+I2?2HI,此反应的特点是前后气体体积不变的反应,故同时增大反应物的浓度,加快化学反应速率,但是平衡状态不变,即转化率不变,故C错误;
D.某物质的溶液中由水电离出的c(H+)=1×10-amol.L-1,此时温度不能确定,故KW不能确定,故D错误,
故选B.
点评 本题主要考查的是盐类水解的应用、盐类水解原理、弱电解质电离平衡影响因素等知识点,属于常考题,注意离子积常数随温度变化,题目难度中等.


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 在常温常压下,2.24L SO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 标准状况下,20g D2O分子中所含中子数为10NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 50mL 12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰汽化需吸收大量的热,这个变化是吸热反应 | |
| B. | 浓硫酸溶于水会放出大量热,这属于放热反应 | |
| C. | 用氢氧焰可以加热软化玻璃制玻璃器皿,这利用了氢气和氧气化合时放出的热量 | |
| D. | 木炭需加热到一定温度时才燃烧,所以木炭燃烧是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2 | |
| B. | 用硝酸酸化的硝酸银溶液能一次鉴别NaCl,NaBr,KI三种失去标签的溶液 | |
| C. | 某溶液中加入CCl4,CC14层显紫色,证明原溶液中存在I- | |
| D. | 某浅黄色的溴水,加入CC14震荡静置后,上层显橙红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
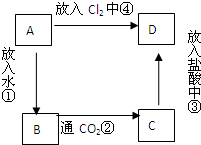 物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按图关系进行转化:
物质A是由A元素组成的单质,将其在酒精灯火焰上灼烧,火焰为黄色,B,C,D是含有A元素的三种不同化合物,A、B、C、D按图关系进行转化:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
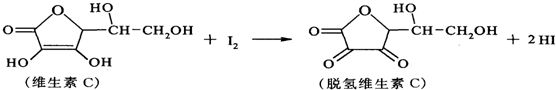
| A. | 上述反应为氧化还原反应 | |
| B. | 维生素C分子中有3种官能团 | |
| C. | 脱氢维生素C不能与氢气发生加成反应 | |
| D. | 脱氢维生素C的分子式为C6H6O6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
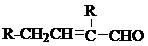
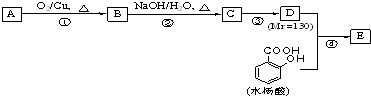
 、HOCH2CH2C≡C-C≡C-COOH、
、HOCH2CH2C≡C-C≡C-COOH、 (其中两种).
(其中两种). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者多 | B. | 后者多 | C. | 一样多 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com