
【题目】取1.06g Na2CO3溶于水配成100ml溶液,求:
(1)Na2CO3溶液的物质的量浓度;________________
(2)Na+ 物质的量浓度; ______________
(3)取出20.0ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求稀释后溶液的体积。_______________
【答案】0.1mol/L0.1mol/L50.0ml
【解析】
(1)用公式n=![]() 计算n(Na2CO3),结合溶液体积计算c(Na2CO3)。
计算n(Na2CO3),结合溶液体积计算c(Na2CO3)。
(2)由c(Na2CO3)和Na2CO3的组成计算c(Na+)。
(3)根据c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液)计算稀释后溶液的体积。
(1)n(Na2CO3)=1.06g÷106g/mol=0.01mol,c(Na2CO3)=0.01mol÷0.1L=0.1mol/L。
(2)c(Na+)=2c(Na2CO3)=2×0.1mol/L=0.2mol/L。
(3)稀释前后Na2CO3物质的量不变,则c(浓溶液)V(浓溶液)=c(稀溶液)V(稀溶液),0.1mol/L×0.02L=0.04mol/LV(稀溶液),解得V(稀溶液)=0.05L=50.0mL,稀释后溶液的体积为50.0mL。


科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的核磁共振氢谱有5个峰,其面积之比为1:2:2:2:3,如下图所示。
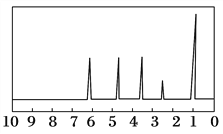
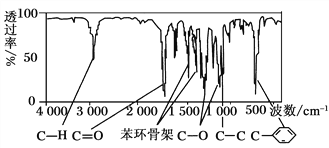
方法三:利用红外光谱仪测得A分子的红外光谱如上图所示。
请填空:
(1)A的分子式为________。
(2)A的分子中含一个甲基的依据是________。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(3)A的结构简式为________。
(4)A的芳香类同分异构体有多种,其中符合下列条件:①分子结构中只含一个官能团;②分子结构中含有一个甲基;③苯环上只有一个取代基。则该类A的同分异构体共有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组变化中,化学反应的反应热前者大于后者的一组是( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H1; CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H2;
②2H2(g)+O2(g)=2H2O(l)△H1; H2(g)+O2(g)=H2O(l)△H2
③t℃时,在一定条件下,将1molSO2和1molO2混合后,分别置于恒容和恒压的两个密闭容器中,达到平衡状态时放出的热量分别为Q1、Q2
④CaCO3(s)=CaO(s)+CO2(g)△H1;CaO(s)+H2O(l)=Ca(OH)2(s)△H2
A. ①③④ B. ②③ C. ①④ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2合成NH3的能量变化如图所示,该反应的热化学方程式是( )

A. N2(g)+3H2(g) = 2NH3(g) ;△H = 2(b—a) kJ/mol
B. N2(g)+3H2(g) = 2NH3(l);△H = 2(a—b—c) kJ/mol
C. ![]() N2(g)+
N2(g)+![]() H2(g) = NH3(l) ;△H = (b+c—a) kJ/mol
H2(g) = NH3(l) ;△H = (b+c—a) kJ/mol
D. ![]() N2(g)+
N2(g)+![]() H2(g) =NH3(g) ;△H = (a+b) kJ/mol
H2(g) =NH3(g) ;△H = (a+b) kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄曲霉素AFTB1,其结构简式如下图所示,它是污染粮食的真菌霉素,人类的P53特殊基因在黄曲霉素的作用下会发生突变,有引发肝癌的可能性。下列说法正确的是

A. 黄曲霉素分子中所有的原子肯定均共面
B. 黄曲霉素分子中含有4个手性碳原子
C. 1mol黄曲霉素最多能与5 mol H2发生加成反应
D. 黄曲霉素可以发生取代、加成、还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾化学式可以用FeSO4xH2O表示,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______、____________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为mg。将样品装入石英玻璃管中,再次将装置A称重,记为ng。按下图连接好装置进行实验。
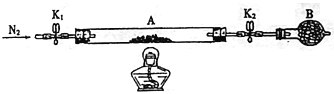
①将下列实验操作步骤正确排序_______(填标号);重复上述操作步骤,直至A恒重,记为Pg。
a.称量A b.关闭K1和K2 c.点燃酒精灯,加热 d.冷却至室温
e.打开K1和K2,缓缓通入N2 f.熄灭酒精灯
②根据实验记录,计算绿矾化学式中结晶水数目=__________(列式表示)。若实验时按c、e次序操作,则使x_____(填“偏大”“偏小”或“无影响”)。
(3)在蒸馏釜中隔绝空气煅烧绿矾,将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,蒸馏釜中剩余的固体为红棕色。绿矾油中溶质的化学式为______________。
(4)用下图装置模拟(3)中蒸馏釜中反应并检验产物,煅烧绿矾一段时间后,发现D中U型管出现无色粘稠的液体,b中品红溶液褪色。

已知:三氧化硫的熔点为16.8℃,沸点为44.8℃
①A中提供热源的仪器名称:______,上述装置正确的连接顺序A→___________ (用大写字母表示)。
②写出煅烧绿矾的化学方程式_____________。
③实验过程中不宜加入过多绿矾,主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为 “零号元素”。下列有关“四中子”粒子的说法不正确的是( )
A.该粒子不显电性B.该粒子质量数为 4
C.在周期表中与氢元素占同一位置D.该粒子质量比氢原子大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为______,晶体中原子间通过_____作用形成面心立方密堆积,其中M原子的配位数为______。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是______(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式),该酸根离子的立体构型为________。
(3)M与Y形成的一种化合物的立方晶胞如图所示。

①该化合物的化学式为_______,已知晶胞参数a=0.542 nm,此晶体的密度为_______g·cm–3。(写出计算式,不要求计算结果。阿伏加德罗常数为NA)
②该化合物难溶于水但易溶于氨水,其原因是________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com