
【题目】(1)①在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是 。
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列中的 。
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(2)甲同学怀疑调整溶液至pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=1.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时就认为沉淀完全,若溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为 ,Fe3+完全沉淀[即c(Fe3+)≤1.0×10-5 mol·L-1]时溶液的pH为 ,通过计算确定上述方案 (填“可行”或“不可行”)。
【答案】(1)①B ②C、D (2)4 3 可行
【解析】
试题分析:(1)①除杂质至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质,四个选项中,只有双氧水氧化后生成水,双氧水受热见光易分解,没有多余杂质,故选B;②调整溶液的pH时,加入的物质不能引进新的杂质粒子,氢氧化钠中含有钠离子,氨水反应后生成铵根离子,所以氢氧化钠和氨水能引进新的杂质离子,CuO粉末、Cu(OH)2悬浊液反应后生成铜离子和水而不引进新的杂质离子,故选CD;
(2)Cu(OH)2的溶度积Ksp=3.0×10-20,溶液中CuSO4的浓度为3.0molL-1,c(Cu2+)=3.0molL-1;依据溶度积常数c(Cu2+)×c2(OH-)=3.0×10-20;c2(OH-)=![]() =10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OH-)=10-14;求的c(H+)=10-4mol/L,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=
=10-20;得到c(OH-)=10-10mol/L,依据水溶液中的离子积c(H+)×c(OH-)=10-14;求的c(H+)=10-4mol/L,溶液pH=4,则Cu(OH)2开始沉淀时溶液的pH为4;残留在溶液中的离子浓度小于1×10-5 molL-1时就认为沉淀完全,Fe(OH)3的溶度积Ksp=8.0×10-38,c(Fe3+)×c3(OH-)=8.0×10-38;c3(OH-)=![]() =8.0×10-33;求的c(OH-)=2×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol/L,则pH=3.3;通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行。
=8.0×10-33;求的c(OH-)=2×10-11mol/L;水溶液中的离子积c(H+)×c(OH-)=10-14;c(H+)=5×10-4mol/L,则pH=3.3;通过计算可知pH=4能达到除去Fe3+而不损失Cu2+的目的,则方案可行。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】化学知识与生产生活息息相关。
I.硅及其化合物
(1)硅及其化合物在现代信息技术中应用广泛。其中用于制造计算机芯片的材料是__________(写化学式),用于制造光导纤维的材料是__________(写化学式)。光导纤维在碱性土壤中易被腐蚀,请写出相关的离子反应方程式______________________
II.氯及其化合物
(2)漂白粉是生活常备用品,其主要成份是__________________(写化学式);漂白粉保存不当易变质,请写出漂白粉失效的方程式________________;如不小心把漂白粉与洁厕灵(主要成份为盐酸)混合,易生成氯气使人中毒。请写出有关反应的离子方程式________________________。
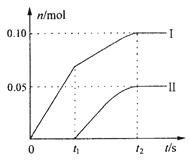
(3)某实验小组,向一定量的石灰乳中缓慢匀速地通入足量氯气,发现产物中还混有了ClO3-,他们讨论后认为,是反应放热温度升高的原因。并画出了ClO-、ClO3-两种离子的物质的量(n)与反应时间(t)的关系曲线,粗略表示为下图(不考虑氯气和水的反应)。
①图中曲线I表示_____________离子的物质的量随反应时间变化的关系。
②所取石灰乳中含有Ca(OH)2的物质的量为__________mol。
③另取一份与②等物质的量的石灰乳,以较大的速率通入足量氯气,反应后测得产物中Cl-的物质的量为0.37mol,则产物中n(ClO-)/n(ClO3-)=______________。
III.氮及其化合物
(4)硝酸生产过程中排放出来的废气,含NO、NO2等大气污染物。
①工业上常用原理:NOx+NH3→N2+H2O,使其转化为无毒的N2,现有NO、NO2的混合3.0L,可与3.5L相同状况的NH3完全反应,全部转化为N2,则在原混合气体中NO和NO2的物质的量之比是_____________;
②已知碱能除去硝酸尾气:2NO2+2NaOH=NaNO2+NaNO3+H2O;NO+NO2+2NaOH=2NaNO2+H2O
根据硝酸尾气处理的反应原理,下列气体中不能被过量NaOH溶液吸收的是_______________
A.1molO2和4molNO2
B.1molO2和4molNO
C.1molNO和5molNO2
D.4molNO和1molNO2
(5)汽车排放的尾气中因含有氮的氧化物而污染大气,造成产生氮的氧化物的主要原因是_____________
A.燃烧含氮化合物燃料
B.燃烧含铅汽油
C.由于燃烧不充分
D.内燃机中空气中的N2在高温下被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. H2SO4溶于水能电离出H+和SO42-,所以硫酸是离子化合物
B. Ba(OH)2晶体中既存在共价键又有离子键
C. SiO2属于原子晶体,熔化破坏共价键和分子间作用力
D. 干冰升华时,分子内共价键会发生断裂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下数据推断丙烷的沸点可能是( )
物质 | 甲烷 | 乙烷 | 丁烷 | 戊烷 |
沸点 | -162 ℃ | -89 ℃ | -1 ℃ | +36 ℃ |
A. 约-40 ℃ B. 低于-160 ℃
C. 低于-89 ℃ D. 高于+36 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图Ⅰ所示的装置制取干燥的氨气。
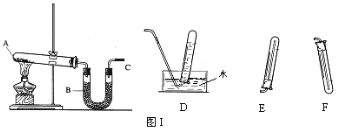
(1)写出A处NH4Cl和Ca(OH)2反应的化学方程式:____________________;
(2)为收集到干燥的氨气C应接(填仪器编号)____________;
(3)B中盛装的试剂是 ;
(4)检验氨气是否集满的方法是__________________________;
(5)在D、E、F三种气体收集方法中,能用于收集一氧化碳的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物,选用了如下图所示的实验装置。

(1)写出浓硫酸与木炭粉在加热条件下的化学方程式______________________。
(2)①中无水硫酸铜的作用是___________________________。
(3)②中酸性KMnO4溶液的作用是__________________________。
(4)②中两次用到品红溶液,它们的作用分别是
A_____________________, B ___________________ 。
(5)③中出现的现象____________________________________________________,
发生反应的离子方程式_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生如下反应mA(g)+nB(g) ![]() pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的
pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的![]() ,当达到新平衡时,C的浓度为原来的1.8倍,下列说法正确的是( )
,当达到新平衡时,C的浓度为原来的1.8倍,下列说法正确的是( )
A.m+n>p B.平衡向逆反应方向移动
C.A的转化率提高 D.C的体积分数增加
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com