
【题目】将Mg和Cu的合金2.64克,投入适量的稀HNO3中恰好反应,固体全部溶解时,收集的还原产物为NO,体积为0.896L (SPt),向反应后的溶液中加入2mol/L NaOH溶液60mL时,金属离子恰好完全沉淀,则形成沉淀的质量为
A. 4.32克 B. 4.68克 C. 5.36克 D. 6.38克
【答案】B
【解析】常规解法:两个反应都恰好完全反应只要其中两个数据联立即可,设混合物中含镁、铜的物质的量分别为X、Y
3Mg + 8HNO3![]() 3Mg(NO3)2 + 2 NO +4H2O --------6OH-(Mg2+ + 2OH-=Mg(OH)2)
3Mg(NO3)2 + 2 NO +4H2O --------6OH-(Mg2+ + 2OH-=Mg(OH)2)
3 2 6
X 2X/3 2X
3Cu + 8HNO3![]() 3Cu(NO3)2 +2NO +4H2O -----------6OH-(Cu2+ + 2OH-=Cu(OH)2)
3Cu(NO3)2 +2NO +4H2O -----------6OH-(Cu2+ + 2OH-=Cu(OH)2)
3 2 6
Y 2Y/3 2Y
联立方程组:24X+64Y=2.64;
(2X/3+2Y/3)*22.4=8.96
解得:X=0.03mol;Y=0.03mol
沉淀质量=Mg(OH)2的质量+Cu(OH)2的质量
=0.03*(24+17*2)+0.03*(64+17*2)
=1.74+2.94
=4.68g
守恒法:根据电子转移守恒可知,Mg、Cu生成8.96LNO转移的电子为:
0.896L=22.4L·mol-1×(5-2)=0.12mol,Mg、Cu在反应中失去电子,最终生成Mg(OH)2 、Cu(OH)2 ,根据电荷守恒可知,生成沉淀需要氢氧根离子的物质的量一定等于Mg、Cu失去电子的物质的量,所以反应后生成沉淀的质量为:2.64g+0.12mol×17g·mol-1=4.68g,故选B。


科目:高中化学 来源: 题型:
【题目】某学生课外活动小组利用右图所示装置分别做如下实验:

(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是_________溶液;加热时溶液由红色逐渐变浅的原因是:________________________________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________________溶液;加热时溶液由无色变为红色的原因是: ______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断错误的是( )
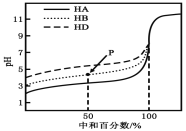
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-)
C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
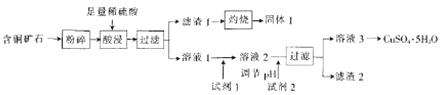
【题目】以某含铜矿石[主要成分是FeCuSi3O13(OH)4,含少量SiO2、CaCO3]为原料制备CuSO4·5H2O的流程如下:
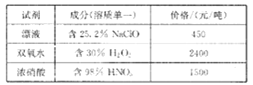
已知相关试剂成分和价格如下表所示:
请回答下列问题:
(1)含铜矿石粉碎的目的是_______。
(2)酸浸后的溶液中除了Cu2+外,还含有的金属阳离子是_______。
(3)固体1溶于NaOH溶液的离子方程式为__________。
(4)结合题中信息可知:所选用的试剂1的名称为_______;加入该试剂时,发生反应的离子方程式为_________。
(5)试剂2 可以选择下列物成中的______。滤渣2中一定含有的物质为______(填化学式)。
A. Cu B.CuO C.Cu(OH)2 D.Fe
(6)CuSO4·5H2O用于电解精炼铜时,导线中通过9.632×103C的电量,测得阳极溶解的铜为16.0g。而电解质溶液(原溶液为1 L)中恰好无CuSO4,则理论上阴极质量增加_____g,原电解液中CuSO4的浓度为__ 。已知一个电子的电量为1.6×10-19C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe3O4是重要的化学试剂,铁粉在氧气中燃烧是制取它最为常见和快捷的方法。
图1是制取四氧化三铁的系列装置,A装置用于制取二氧化碳气体,并要求气流稳定,流速可控。

请回答下列问题:
(1)图2中仪器a的名称是________。
(2)根据题目要求,在图2中最好选择________(填序号)作为A装置。
(3)对图2中装置①进行气密性检查的方法是________,向分液漏斗中加足量水,过一会,水不再下滴,说明装置①的气密性良好。
(4)在B装置中发生的主要反应的化学方程式是_____________。
(5)当产生的气体与事先预热的铁粉接触时,在硬质玻璃管中将观察到的明显现象是_____________。
(6)反应一段时间后,若将硬质玻璃管中的固体粉末用盐酸溶解,取少许溶液于试管中,加入淀粉碘化钾溶液,没有蓝色出现,推测固体粉末中除Fe3O4外,一定有_________。
(7)若铁粉被完全消耗,某同学为确定生成物中有+2价铁,取少量生成物于试管中,加入适量的稀硫酸溶解。
①写出溶解过程发生反应的离子方程式____________________。
②写出确定+2价铁所用试剂名称、操作步骤、实验现象和结论__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2A(g) + 3B(g) ![]() 2C(g)+D(g),在四种不同条件下的反应速率分别为:
2C(g)+D(g),在四种不同条件下的反应速率分别为:
①υ(A)=0.5mol·L-1·min-1 ②υ(B)=0.6 mol·L-1·min-1
③υ=0.35 mol·L-1·min-1 ④υ(D)=0.4 mol·L-1·min-1
该反应在这四种不同条件下反应速率由快到慢的顺序是
A. ①②③④ B. ②①④③ C. ④①②③ D. ②④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现:具有2、8、20、28、50、82、114、126、184等数目的质子或中子的原子核具有特别的稳定性,并将这些数称为“幻数”,而具有双幻数的He、![]() Ni、
Ni、![]() 、
、![]() 等尤为稳定。根据此信息回答下列问题:
等尤为稳定。根据此信息回答下列问题:
(1)写出元素周期表中前三种质子数为“幻数”的元素原子的结构示意图,并标明元素符号:_____________、______________、___________。
(2)已知氧有三种同位素![]() 、
、![]() 、
、![]() ,根据上述“幻数”规律,氧的同位素中原子核最稳定的是__________。
,根据上述“幻数”规律,氧的同位素中原子核最稳定的是__________。
(3)根据现有元素周期律推算,![]() R位于元素周期表的第________周期第________族,核稳定性
R位于元素周期表的第________周期第________族,核稳定性![]() R________
R________![]() R(填“>”、“<”或“=”)。
R(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com