
A、已知
| ||||||||||
| B、能说明NH3结合H+能力比H2O强:NH3+H3O+=NH+4+H2O | ||||||||||
| C、已知下列热化学方程式:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,则氢气的燃烧热为-242kJ/mol | ||||||||||
| D、已知中和热为-57.4kJ/mol,则NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l);△H=-57.4kJ/mol |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、(l0b-5a))mol/L | ||||
| B、(2b-a)mol/L | ||||
C、(
| ||||
D、(5b-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 在如图中,甲烧杯中盛有100mL 0.50mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.25mol?L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.52g,则
在如图中,甲烧杯中盛有100mL 0.50mol?L-1 AgNO3溶液,乙烧杯中盛有100mL 0.25mol?L-1 CuCl2溶液,A、B、C、D均为质量相同的石墨电极,如果电解一段时间后,发现A极比C极重1.52g,则查看答案和解析>>
科目:高中化学 来源: 题型:
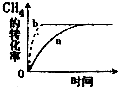 碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.
碳及其化合物在人类生产、生活中的应用非常广泛.“低碳生活”不再只是一种理想,更是一种值得期待的生活方式.| 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、9gD2O所含有的质子数为5NA |
| B、100mL1mol?L-1AlCl3溶液中含的阳离子数大于0.1NA |
| C、25℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01 NA |
| D、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 23.54 | 20.00 |
| 2 | 0.10 | 23.96 | 20.00 |
| 3 | 0.10 | 24.00 | 20.00 |
| 4 | 0.10 | 24.04 | 20.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com