
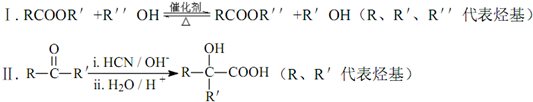
 .
. .
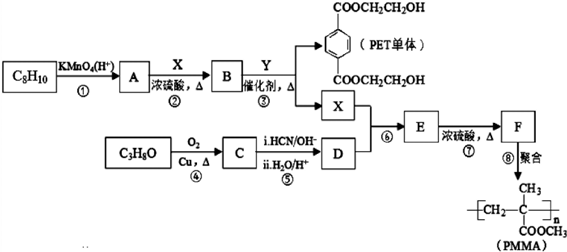
.分析 根据题中各物质转化关系,由于F发生加聚反应得PMMA,所以由PMMA的结构可反应推得F为CH2=C(CH3)COOCH3,C3H8O氧化得C,C发生信息Ⅱ的反应,C先加成后水解得D,可推得C为CH3COCH3,所以D为(CH3)2C(OH)COOH,根据F的结构及D和X发生酯化反应生成E,E在浓硫酸作用下加热发生消去反应得F,可推断E为(CH3)2C(OH)COOCH3,所以X为CH3OH,根据PET单体和X的结构结合信息Ⅰ可知,B和Y发生取代反应生成PET单体和X,再结合C8H8发生氧化反应得A,A与X发生取代反应得B,可推得C8H8为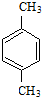 ,B为
,B为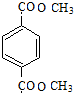 ,Y为HOCH2CH2OH,A为
,Y为HOCH2CH2OH,A为 ,据此答题.
,据此答题.
解答 解:根据题中各物质转化关系,由于F发生加聚反应得PMMA,所以由PMMA的结构可反应推得F为CH2=C(CH3)COOCH3,C3H8O氧化得C,C发生信息Ⅱ的反应,C先加成后水解得D,可推得C为CH3COCH3,所以D为(CH3)2C(OH)COOH,根据F的结构及D和X发生酯化反应生成E,E在浓硫酸作用下加热发生消去反应得F,可推断E为(CH3)2C(OH)COOCH3,所以X为CH3OH,根据PET单体和X的结构结合信息Ⅰ可知,B和Y发生取代反应生成PET单体和X,再结合C8H8发生氧化反应得A,A与X发生取代反应得B,可推得C8H8为 ,B为
,B为 ,Y为HOCH2CH2OH,A为
,Y为HOCH2CH2OH,A为 ,
,
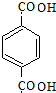
(1)根据上面的分析可知,A的结构简式是 ,
,
故答案为: ;
;
(2)D为(CH3)2C(OH)COOH,D中含有的官能团名称是羟基和羧基,
故答案为:羟基和羧基;
(3)根据上面的分析可知,反应④~⑦中,属于消去反应的是 ⑦,
故答案为:⑦;
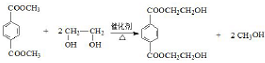
(4)反应③的化学方程式是 ,
,
故答案为: ;
;
(5)符合下列条件a.与F含有相同的官能团,b.能与新制银氨溶液反应产生银镜,则有醛基,c.核磁共振氢谱显示只有三组峰,这样的F的同分异构体的结构简式为HCOOCH=C(CH3)2,
故答案为:HCOOCH=C(CH3)2.
点评 本题考查有机物的推断与合成,注意根据充分利用题中信息和有机物的结构进行推断,明确有机物的官能团及其性质是解本题关键,难度中等


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 明矾用于净水 | 明矾具有消毒杀菌的作用 |
| B | 含硫煤中加入适量石灰石可减少对大气的污染 | 使煤燃烧产生的SO2最终生成CaSO4 |
| C | 钢铁在海水中比在河水中更易腐蚀 | 海水中含氧量高于河水 |
| D | “地沟油”可以用来制生物柴油 | 其主要成分和从石油中提取的柴油类似 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
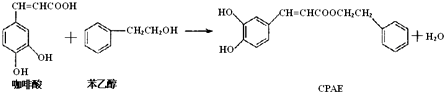
| A. | 咖啡酸分子中所有原子可能处在同一个平面上 | |
| B. | 1 mol CPAE与足量的NaOH溶液反应,最多消耗3 mol NaOH | |
| C. | 可用金属Na检测上述反应是否残留苯乙醇 | |
| D. | 1 mol 苯乙醇在O2中完全燃烧,需消耗10 mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X的原子半径一定大于Y的原子半径 | |
| B. | X与Y的简单离子可能具有相同的电子层结构 | |
| C. | 两元素形成的化合物中,原子个数比可能为1:1 | |
| D. | X与Y不可能位于同一周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 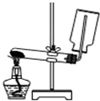 制备和收集氧气的实验装置 | |
| B. |  蒸馏海水的实验装置 | |
| C. |  导气管插入碳酸钠溶液液面下可防止乙酸乙酯挥发 | |
| D. |  制取氢氧化亚铁时能观察到白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH3分子中有未成键的孤对电子 | B. | PH3是非极性分子 | ||
| C. | 它的分子构型是平面三角形 | D. | 磷原子采用sp2杂化方式 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com