
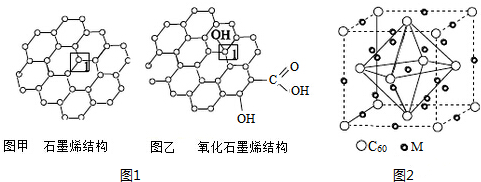
分析 (1)石墨烯中每个C原子和相邻3个碳原子形成3个σ键;
(2)氧化石墨烯中每个C原子形成4个σ键,价层电子对个数是4,根据价层电子对互斥理论判断C原子杂化方式;乙中每个碳原子和3个C、1个O原子形成四面体结构,甲中每个C原子和相邻3个碳原子形成平面结构;
(3)乙中含有C、H、O元素,元素的非金属性越强,其电负性越大;元素越易失电子,其第一电离能越小;
(4)氢键能增大物质的溶解性;
(5)氧化石墨烯中含有羟基、羧基,具有醇和羧酸的性质;
(6)M原子个数=8+12×$\frac{1}{4}$+1;C60个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4.
解答 解:(1)由图可知,甲中1号C与相邻C形成3个C-C键,形成σ键的个数为3,故答案为:3;
(2)图乙中,1号C形成3个C-C及1个C-O键,C原子以sp3杂化,为四面体构型,而石墨烯中的C原子杂化方式均为sp2,为平面结构,则图乙中C与相邻C形成的键角<图甲中1号C与相邻C形成的键角,故答案为:sp3;<;
(3)乙中含有C、H、O元素,元素的非金属性越强,其电负性越大;元素越易失电子,其第一电离能越小,C、H、O第一电离能大小顺序是O>H>C,电负性从小到大顺序是H<C<O,故答案为:O>H>C;H<C<O;
(4)氧化石墨烯与水分中子间形成氢键,从而促进氧化石墨烯溶解,故答案为:氧化石墨烯与水分中子间形成氢键;
(5)氧化石墨烯中含有羟基、羧基,具有醇和羧酸的性质,所以能和乙醇发生酯化反应、和硝酸发生酯化反应、和NaOH及碳酸氢钠发生复分解反应,故选ABCD;
(6)M原子个数=8+12×$\frac{1}{4}$+1=12、C60个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则C60与M原子个数之比=4:12=1:3,其化学式为 M3C60,故答案为:12; M3C60.
点评 本题考查物质结构和性质,把握杂化类型、成键方式、氢键形成及晶胞均摊法计算为解答的关键,难点是计算M原子个数,题目难度中等.


科目:高中化学 来源: 题型:选择题
 一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 平衡前,随着反应的进行,容器内气体的相对分子质量始终不变 | |
| B. | 平衡时,其他条件不变,取出适当铁可提高CO的转化率 | |
| C. | 该反应的△H<0,K1<K2=1.5 | |
| D. | 当反应进行到t1时刻仅改变一个条件,可能是通入了氮气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
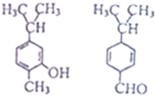
| A. | 互为同分异构体 | B. | 可用银氨溶液区分 | ||
| C. | 均能与溴水反应但反应类型不同 | D. | 分子中共平面的碳原子数一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 盐酸 | 50mL | 50mL | 50mL |
| m(混合物) | 9.2g | 14.2g | 27.6g |
| V(CO2)(标准状况) | 2.24L | 3.36L | 3.36L |
| A. | 盐酸的物质的量浓度为3.0 mol/L | |
| B. | 当混合物质量为9.2 g时,50 mL盐酸恰好完全反应 | |
| C. | 混合物中NaHCO3、KHCO3的物质的量之比为1:2 | |
| D. | 混合物中NaHCO3的质量分数为45.7% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com