
下列关于浓硫酸的叙述不正确的是( )
|
| A. | 浓硫酸具有脱水性,因而能使蔗糖炭化 |
|
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体 |
|
| C. | 浓硫酸是一种干燥剂,能够干燥二氧化硫、氢气等气体 |
|
| D. | 浓硫酸在常温下能够使铁、铝等金属钝化 |
| 浓硫酸的性质. | |
| 专题: | 氧族元素. |
| 分析: | 浓硫酸具有吸水性、脱水性和强氧化性,所以浓硫酸能将部分有机物碳化、能作干燥剂等. |
| 解答: | 解:A.浓硫酸具有脱水性,能将蔗糖中的H、O以2:1水的形式脱去而体现脱水性,故A正确; B.浓硫酸在常温下和铜不反应,在加热条件下和铜反应生成二氧化硫,故B错误; C.浓硫酸具有吸水性,能作部分气体的干燥剂,如二氧化硫、氢气等,故C正确; D.常温下,浓硫酸和铁、铝能发生氧化还原反应而生成一层致密的氧化物薄膜而阻止进一步被氧化,该现象为钝化现象,故D正确; 故选B. |
| 点评: | 本题考查了浓硫酸的性质,明确浓硫酸的三大性质是解本题关键,注意吸水性和脱水性的区别,题目难度不大. |


科目:高中化学 来源: 题型:
某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O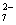 转
转
化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4·24H2O]即可对该反应起催化作用。为进一步研究
有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
| 实验编号 | 初始pH | 废水样品体积mL | 草酸溶液体积mL |
|
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 |
测得实验①和②溶液中的Cr2O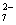 浓度随时间变化关系如图所示。
浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式)。
(3)实验①和②的结果表明  ;实验①中0~t1时间段反应速率v(Cr3+)= mol·L-1·min-1
;实验①中0~t1时间段反应速率v(Cr3+)= mol·L-1·min-1
(用代数式表示)。
(4)该课题组队铁明矾[Al2Fe(SO4)4·24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二: ;
假设三: ;
……
(5)请你设计实验验证上述假设一,完成下表中内容。
(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、Al2Fe(SO4)4·24H2O、Al2(SO4)3等,溶液中Cr2O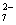 的浓度可用仪器测定。)
的浓度可用仪器测定。)
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 水煤气 | 硫酸 | 醋酸 | HD |
| B | 胆矾 | 石灰水 | 硫酸钡 | Al(OH)3 | NH3 |
| C | 火碱 | 蔗糖溶液 | 氯化钠 | 氨水 | 三氧化硫 |
| D | 冰醋酸 | 福尔马林 | 苛性钾 | 碘化氢 | 乙醇 |
A. A B. B C. C D. .D
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验装置进行的相应实验,能到达实验目的地( )
|
| A. |
除去Cl2中含有的少量HCl |
|
| B. |
蒸干FeCl3饱和溶液制备FeCl3晶体 |
|
| C. |
制取少量纯净的CO2气体 |
|
| D. |
分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:
用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:下列叙述正确的是( )
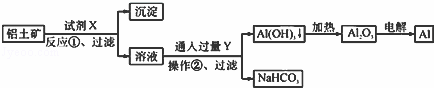
|
| A. | 试剂X可以是盐酸 |
|
| B. | 反应①过滤后所得沉淀为氢氧化铁 |
|
| C. | 图中所示转化反应都不是氧化还原反应 |
|
| D. | 操作②中发生的化学方程式为NaAlO2+2H2O+CO2=Al(OH)3↓+NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
氧化铜有多种用途,如用作玻璃着色剂、油类脱硫剂等.为获得纯净的氧化铜,某同学用工业硫酸铜(含硫酸亚铁等杂质)进行如下实验:
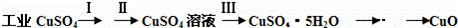
经查阅资料得知,在溶液中通过调节溶液的酸碱性而使Cu2+、Fe2+、Fe3+分别生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
(1)步骤Ⅰ的目的是除不溶性杂质.所需操作的名称是 溶解、过滤 .
(2)步骤Ⅱ的目的是除硫酸亚铁.操作步骤是先滴加H2O2溶液,稍加热,当Fe2+转化完全后,慢慢加入Cu2(OH)2CO3粉末,搅拌,以调整溶液pH在一定范围之内,加热煮沸一段时间,过滤,用稀硫酸酸化滤液至pH=1.
①写出用H2O2溶液除去硫酸亚铁的离子方程式 .
②调整pH 的范围应该在 之间.
(3)步骤Ⅲ的目的是得到CuSO4•5H2O晶体.操作是将溶液加热蒸发至有晶膜出现时,停止加热, ,水浴加热烘干.采用水浴加热的原因是 .
(4)该同学用CuSO4溶液进行如下探究实验:
取A、B两支试管,分别加入 2mL 5% H2O2溶液,再向H2O2溶液中分别滴入0.1mol•L﹣1FeCl3和CuSO4 溶液各1mL,摇匀,观察到滴入FeCl3 溶液的试管产生气泡更快,由此得到结论:Fe3+对H2O2溶液分解的催化效率比Cu2+高,该同学的结论是否正确 (填正确或错误),请说明原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某校学生用化学知识解决生活中的问题,下列家庭小实验不合理的是
A.用米汤检验含碘盐中的碘酸钾(KIO3)
B.用食醋除去暖水瓶中的薄层水垢
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com