
【题目】下列叙述正确的是
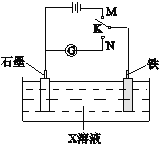
A. K与N连接时,X为硫酸,一段时间后溶液的pH增大
B. K与N连接时,X为氯化钠,石墨电极反应:2H++2e-=H2↑
C. K与M连接时,X为硫酸,一段时间后溶液的pH增大
D. K与M连接时,X为氯化钠,石墨电极反应:4OH--4e-=2H2O+O2↑
【答案】A
【解析】试题分析:A、K与N连接时,X为硫酸,构成原电池,铁作负极,石墨作正极,负极上铁失电子生成亚铁离子,正极上氢离子放电生成氢气,溶液中氢离子浓度降低,pH增大,A正确;B、K与N连接时,X为氯化钠,构成原电池,铁作负极,石墨作正极,属于铁的吸氧腐蚀,即石墨上氧气得电子发生还原反应,电极反应式为2H2O+O2+4e-=4OH-,B错误;C、K与M连接时,X为硫酸,构成电解池。石墨与电源的正极相连作阳极,铁作阴极。阳极上氢氧根放电,阴极上氢离子放电,电解的实质是电解水。硫酸的物质的量不变,体积减小,硫酸浓度增大,酸性增强溶液的pH减小,C错误;D、K与M连接,X为氯化钠,构成电解池,石墨与电源的正极相连作阳极,铁作阴极,阳极上氯离子放电,电极反应式为2Cl--2e-=Cl2↑,D错误,答案选A。


科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是人类获取能量的重要途径。
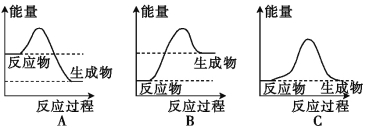
(1)液化气是一种重要的家用燃料,下列示意图与液化气在燃烧过程中的能量变化最相符的是 (填字母)。
(2)“冰袋”可用于短时间保鲜食物。将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手将袋内两种固体粉末充分混合,便立即产生低温。由此判断:碳酸钠晶体与硝酸铵晶体的总能量 (填“高于”或“低于”)反应后生成产物的总能量。
(3)化学反应中的能量变化不仅仅表现为热量的变化,有时还可以表现为其他形式的能量变化。比如,蜡烛燃烧可用来照明,这个过程是将化学能转化为 和 ;人们普遍使用的干电池工作时是将化学能转化为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
(提出猜想)
猜想1:__________________________________;
猜想2:__________________________________;
猜想3:__________________________________。
为了验证猜想,该小组设计实验加以探究。
(实验探究)
该小组同学按如图所示装置,将气体从a端通入。
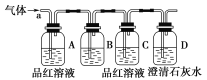
(1)B中应该放________试剂(填编号)。
a.NaCl溶液 B.酸性KMnO4溶液
c.盐酸 D.澄清石灰水
(2)A中品红溶液的作用是_________________________________________。
(3)D中澄清石灰水的作用是_______________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色
②C中品红溶液不褪色
③D中澄清石灰水变浑浊
(得出结论)
(4)由上述现象该小组同学确认该气体为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、X存在如图所示转换关系,其中,A是一种正盐,B是气态氢化物,C是单质,F是强酸。X可能是强酸,也可能是强碱。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
(1)A的化学式是________。
(2)若X是强酸,将D与Cl2同时通入水中发生反应的离子方程式为____________________。
(3)若X是强碱,过量的B跟Cl2反应除生成C外,另一产物是氯化物。
①过量的B跟Cl2反应的化学方程式为___________________________。
②工业生产中B→D的化学方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量变化的角度来认识,下面说法中,正确的是( )
A.化学变化都是放热的
B.化学变化都是吸热的
C.反应物所含能量等于生成物所含能量
D.化学反应前后反应物和生成物所含能量会发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是
A.第 IA 族的所有元素都是金属元素
B.同周期主族元素中,第ⅦA 族元素原子半径最小
C.稀有气体元素原子的最外层电子数均为 8
D.元素周期表共有 7 个周期,18 个族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。图是硫元素的常见化合价与部分物质类别的对应关系:
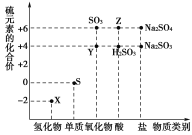
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有____________________(填化学式)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为________。
(3)检验物质Y的方法是_________________________________________。
(4)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为______________________________________________________________。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是________(填字母)。
a.Na2S+S b.Na2SO3+S
c.SO2+Na2SO4 d.Na2SO3+Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将等体积的NO和O2一同置于试管中,并将试管倒立于水中,充分反应后剩余气体的体积约为原气体总体积的( )
A. 1/4 B. 3/4
C. 1/8 D. 3/8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中用下列装置制FeCl3,可供选择的试剂有:①MnO2 ②NaOH溶液 ③饱和NaCl溶液 ④浓硫酸 ⑤浓盐酸。

(1)按气体流向由左到右排列,各装置的连接顺序为(填写A~E序号):__接__接___接__接__。
(2)装置连接好后,应该首先进行的实验操作是____________________________________________。
(3)A装置烧瓶中反应的离子方程式是_________________________________________。
(4)E中盛装的试剂是________,其作用是_________________________________________。
(5)停止反应后,还有铁丝剩余。为检验FeCl3的生成,并最终得到FeCl3溶液,甲同学设计以下实验步骤:
a.待B装置玻璃管冷却后,将管中物质用水溶解,________(填操作方法)除去不溶物;
b.取少量滤液,滴加________溶液,溶液呈现红色,以此检验Fe3+;
c.取少量滤液,滴加硝酸酸化的AgNO3溶液,检验Cl-。
(6)乙同学认为甲的实验设计不能最终得到FeCl3溶液,其理由是(写出相应的离子反应方程式)__________________________________________________________________。
你认为还选择下列哪些试剂才能制得较为纯净的FeCl3溶液________。
A.KMnO4(H+) B.Fe C.H2O2 D.Cl2 E.盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com