
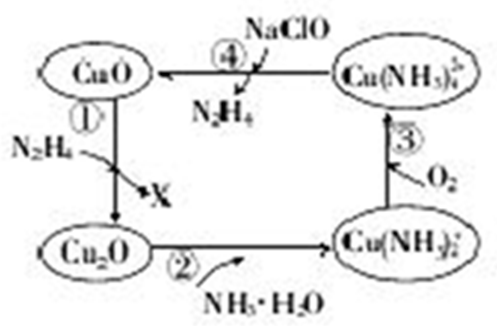
分析 (1)非氧化还原反应即无元素化合价变化的反应;
(2)在反应①中,N2H4做还原剂,CuO做氧化剂,根据氧化剂与还原剂的物质的量之比为4:1,据此分析X;
(3)发生Cu2O+4NH3•H2O=2Cu(NH3)2++2OH-+3H2O,碱性增强;
(4)温度高时氢氧化铜分解,且气体溶解度随温度升高而降低;
(5)反应③4Cu(NH3)2++8NH3+2H2O+O2=4Cu(NH3)42++4OH-、④Cu(NH3)42++2ClO-+2OH-═Cu(OH)2↓+2N2H4↑+2Cl-+2H2O,反应过程中,Cu元素化合价由+1价变为+2价,O元素化合价由0价变为-2价,根据转移电子守恒计算.
解答 解:(1)非氧化还原反应即无元素化合价变化的反应,反应②中铜元素、氮元素和氢元素以及氧元素的化合价均没有变化,故为非氧化还原反应,
故答案为:②;
(2)在反应①中,N2H4做还原剂,CuO做氧化剂,则X为氧化产物,设X中氮元素为a价,则根据氧化剂与还原剂的物质的量之比为4:1有:4×(2-1)=1×2×(a-2+2),可解得a=0,即X为氮气,
故答案为:N2;
(3)转化②中的离子方程式为:Cu2O+4NH3•H2O=2Cu(NH3)2++2OH-+3H2O,故溶液中氢氧根的物质的量增大,溶液中m(OH-)增大,
故答案为:增大;
(4)温度高时氢氧化铜分解,且气体溶解度随温度升高而降低,从而促进反应向正反应方向进行,即该反应需在80℃以上进行,降低肼的溶解度,促使其从溶液中逸出,
故答案为:使氢氧化铜分解;降低肼的溶解度,促使其从溶液中逸出;
(5)在整个转化过程中满足铜元素的守恒,故若①中参加反应的CuO物质的量为0.4mol,按图示转化过程进行后,④中生成的CuO物质的量也等于0.4mol,
反应③4Cu(NH3)2++8NH3+2H2O+O2=4Cu(NH3)42++4OH-,若①中参加反应的CuO物质的量为0.4mol,根据铜元素的守恒,参加n[Cu(NH3)2+]=0.4mol,
参加反应的O2的物质的量n(O2)=0.1mol,反应④Cu(NH3)42++2ClO-+2OH-═Cu(OH)2↓+2N2H4↑+2Cl-+2H2O,根据铜元素的守恒,参加n[Cu(NH3)42+]=0.4mol,则④中参加反应的NaClO的物质的量n(NaClO)=0.8mol,所以③中参加反应的O2的物质的量与④中参加反应的NaClO的物质的量之比为1:8,
故答案为:1:8.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及元素的化合价变化为解答的关键,侧重分析与应用能力的考查,(5)注意计量数与物质的量变化量关系,为该题解答难点,题目难度中等.


科目:高中化学 来源: 题型:选择题
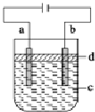
| A. | a电极的材料应为铁 | |
| B. | d为苯,其作用为防止空气中的O2把Fe(OH)2氧化 | |
| C. | 电解液c可以是NaCl溶液、NaOH溶液等 | |
| D. | 若电解过程中阳极消耗铁11.2g,理论上阴极产生气体为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Y>Z,离子半径Z-<M2+ | |
| B. | MX2与水发生反应时,MX2只做氧化剂 | |
| C. | X、Y形成的化合物既能与强酸反应又能与强碱反应 | |
| D. | MX2、MZ2两种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
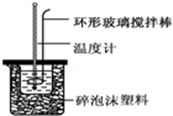 实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:
实验室用50mL 0.50mol•L-1盐酸、50mL 0.55mol•L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:完成下列问题:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解后溶液中c(H+)为2 mol•L-1 | B. | 上述电解过程中转移电子总数为NA | ||
| C. | 电解得到的Cu的物质的量为1 mol | D. | 原混合溶液中 c(K+)为5 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 装置 | 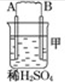 | 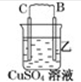 | 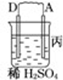 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
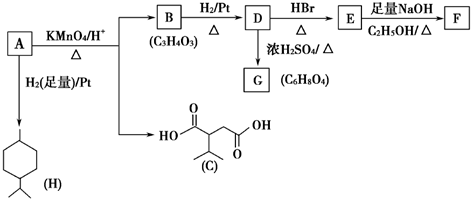
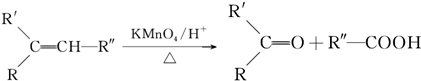
 .
. .
.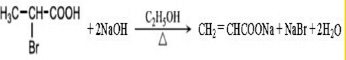 .
.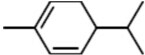 ,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).
,A与等物质的量的Br2进行加成反应的产物共有3种(不考虑立体异构).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com