
【题目】除去下列物质所含的杂质(括号内的物质)所选用的试剂不正确的是( )
A.乙酸(苯甲酸):NaOH溶液
B.甲烷(乙炔):溴水
C.苯(苯甲酸):NaOH溶液
D.乙炔(硫化氢):亚硫酸钠酸性溶液
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( ) 
A.杠杆为导体和绝缘体时,均为A端高,B端低
B.杠杆为导体和绝缘体时,均为A端低,B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种优质燃料,
(1)已知一定条件下88gCO2和足量氢气完全反应三可生成气态甲醇(CH3OH)和水蒸汽并放出98kJ的热量.请回答:①该反应的热化学方程式: .
②若生成3mol甲醇放出的热量为 .
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2 , 一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图.请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)= .
②下列措施中能使v(CO2)增大的是 .
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.升高温度
③能够说明该反应已达到平衡的是 .
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度不再变化
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH.
E.有2个C=O键断裂的同时,有3个H﹣H键断裂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘化钡(BaI22H2O)是一种白色粉末,常用于制取其他含碘化合物.一种制备流程如图1: 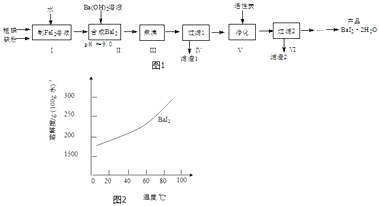
(1)步骤Ⅰ制FeI2溶液时,提高反应速率的可行措施有(填序号).
a.铁粉和碘粉用球磨机磨成细粉
b.增大n(铁粉):n(碘)的配料比
c.适当升高反应温度和搅拌速度
d.向反应器中加水至I2全部溶解
(2)步骤Ⅱ发生反应的化学方程式为;用pH试纸测定溶液pH的方法是
(3)步骤Ⅲ小心“煮沸”约20分钟,可使Fe(OH)2颗粒长大,其目的是;步骤V加入活性炭的目的是 .
(4)从过滤2所得滤液中获得BaI22H2O(溶解度曲线如图2所示)的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素.原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和.
(1)A为元素,B为元素;C为元素.D的质子数和中子数相等,D的原子组成符号为 , 它的最高价为价.
(2)用电子式表示A、D两元素形成AD2的过程: , 用电子式表示C、D两元素形成化学键的过程: .
(3)写出E和A的最高价氧化物反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染.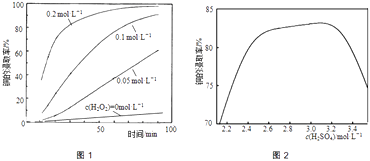
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为 .
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2﹣HCl﹣NaCl混合溶液浸取回收.
①用FeCl3溶液浸取铜时发生反应的离子方程式为;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是 .
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3molL﹣1盐酸、0.5molL﹣1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图1所示.当c(H2O2)=0molL﹣1时,也有少量的铜被浸出,其原因是 .
③用H2O2﹣HCl﹣NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ) Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ) Cu2++Cu2Cu+
(Ⅲ) Cu++nCl﹣CuCln(n﹣1)﹣
(Ⅳ) 2CuCln(n﹣1)﹣+2H++H2O2=2Cu2++2H2O+2nCl﹣
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是(填序号).
a.Na+ b.Cu2+ c.Cl﹣d.OH﹣
(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl﹣H2O2混合溶液浸取.
①Cu2S被HCl﹣H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为 .
②若由H2SO4代替HCl﹣H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图2所示.当H2SO4浓度大于3.1molL﹣1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如图: ![]()
(1)Co2+基态核外电子排布式为 .
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为(填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 .
(3)与NO2﹣互为等电子体的单质分子为(写化学式).
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 .
(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图 ![]() 所示,1molNDMA分子中含有σ键的数目为mol.
所示,1molNDMA分子中含有σ键的数目为mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图1和图2是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质是
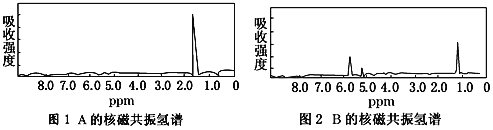
A. A是C3H6;B是C6H6 B. A是C2H6;B是C3H6
C. A是C2H6;B是C6H6 D. A是C3H6;B是C2H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com