
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:阅读理解
| 名称 | 性质 |
| 乙二醇 | 无色粘稠吸湿液体,易燃,沸点:196~198℃,与水混溶. |
| 丙酮 | 无色易燃液体,沸点:56.5℃,溶于水及大多数有机溶剂. |
| N,N二甲基甲酰胺(DMF) | 易燃,低毒,沸点:153℃,能与水和大多数有机溶剂混溶. |
| 对苯二甲酸(TPA) | 白色针状结晶或粉末,可燃,熔点:425℃(分解),约在300℃升华,不溶于水,微溶于热乙醇,溶于碱溶液.电离常数:Ka1=3.1×10-4,Ka2=1.5×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

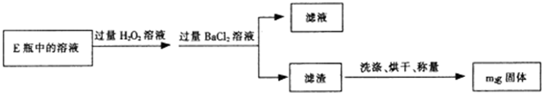
| 32m2 |
| 233m1 |
| 32m2 |
| 233m1 |
| 2.8cV |
| m1 |
| 2.8cV |
| m1 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
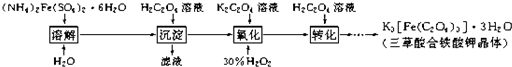
查看答案和解析>>
科目:高中化学 来源:2010届莆田四中高三第三次模拟考试理综化学部分 题型:实验题
(15分)MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下3个方案以验证MnO2的氧化性,可行的是 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。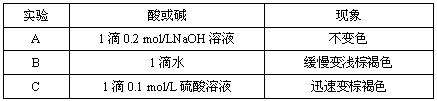
该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2 =KOH +I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。 。
(5)实验室用二氧化锰和浓盐酸制取干燥的氯气,下列仪器中不需要用到的是 (填序号)。
a.长颈漏斗 b.圆底烧瓶 c.温度计 d.酒精灯 e.洗气瓶 f.烧杯
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下3个方案以验证MnO2的氧化性,可行的是 。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298K,设计如下对比试验。

该小组从上述对比实验中,可以得出的结论是 。
写出在酸性条件下,MnO2氧化I-的离子方程式 。
(3)欲探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1g/cm3)配制浓度3%的H2O2溶液(密度近似为1g/cm3)100mL。其配制方法是:用量筒量取 mL30%H2O2溶液放入 (填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2 =KOH +I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确。 。
(5)实验室用二氧化锰和浓盐酸制取干燥的氯气,下列仪器中不需要用到的是 (填序号)。
a.长颈漏斗 b.圆底烧瓶 c.温度计 d.酒精灯 e.洗气瓶 f.烧杯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com