
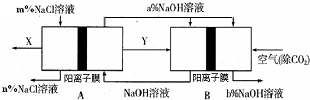
 氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )
氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )| A、X为H2,Y为Cl2 |
| B、A池为电解池,且m<n |
| C、B池为燃料电池,且a>b |
| D、该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度 |


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
 Na2O2是常见的氧化剂.某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
Na2O2是常见的氧化剂.某化学小组的同学欲通过以下实验确定炭粉与Na2O2反应的产物.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用厨余垃圾生产沼气 |
| B、废旧塑料露天焚烧防止产生白色污染 |
| C、废旧电池就地填埋 |
| D、用医疗垃圾中的废塑料生产一次性水杯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多 |
| B、加水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、溶液中粒子浓度大小关系为:c(H+)>c(CH3COOH)>c(CH3COO-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
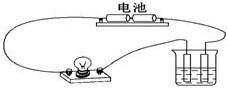 用图示所示装置分别进行如下实验,测定导电性变化,按照要求选择填空.
用图示所示装置分别进行如下实验,测定导电性变化,按照要求选择填空.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g NH4+ 所含质子数为10NA |
| B、常温常压下,NA个氢分子的质量为1g |
| C、2mol金属铝与足量的盐酸反应,共失去了4NA个电子 |
| D、在同温同压时,相同体积的任何气体单质所含的分子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com