
| A. | 甲烷是天然气的主要成分,能发生取代反应,但不能发生氧化反应 | |
| B. | 实验室中,可用金属钠检验乙醇中是否含有水 | |
| C. | 只用水无法鉴别苯、乙酸和四氯化碳 | |
| D. | 植物油不能用于萃取溴水中的溴 |
分析 A、甲烷能燃烧;
B、金属钠能和乙醇反应生成氢气;
C、苯难溶于水且密度比水小,而四氯化碳难溶于水且密度比水大,乙酸能和水互溶;
D、植物油是不饱和高级脂肪酸和甘油形成的酯类.
解答 解:A、天然气的主要成分为甲烷,能发生取代反应,和酸碱盐以及一般的氧化剂不反应,但甲烷能在氧气中燃烧,故能发生氧化反应,故A错误;
B、金属钠能和乙醇反应生成氢气,故不能用于检验乙醇中是否含水,故B错误;
C、苯难溶于水且密度比水小,而四氯化碳难溶于水且密度比水大,乙酸能和水互溶,三者和水混合后的现象各不相同,故只用水即可鉴别,故C错误;
D、植物油是不饱和高级脂肪酸和甘油形成的酯类,故植物油中含碳碳双键,能和溴水发生加成反应,故不能用于萃取溴水中的溴,故D正确.
故选D.
点评 本题考查了甲烷的性质.乙醇中是否含水的检验和有机物的鉴别等,应注意的是乙醇中是否含水应用无水硫酸铜来检验,通过是否变蓝即可得知.


科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方法 | |
| A. | 从食盐水中获得食盐 | 过滤 |
| B. | 将海水淡化为可饮用水 | 蒸发 |
| C. | 分离水和碘的四氯化碳溶液 | 分液 |
| D. | 分离碳酸钠溶液和乙酸乙酯 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾在常用危险化学品分类中属于易燃固体 | |
| B. | 实验中不慎打破温度计,可用吹风机加快水银的蒸发 | |
| C. | 做蒸发结晶实验时,用坩埚钳夹持热蒸发皿直接放于实验台面上 | |
| D. | 做分液操作时,待液体分层将下层液体从下口放出后,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
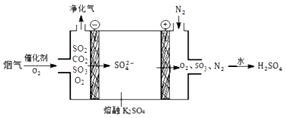 煤炭燃烧中会产生大量烟气容易透成污染,用下图所示的电解池在较高温度下反应,可以净化烟气,月下列列断不正确的是( )
煤炭燃烧中会产生大量烟气容易透成污染,用下图所示的电解池在较高温度下反应,可以净化烟气,月下列列断不正确的是( )| A. | 据图可知,阳极反应式为SO42--2e-=SO2↑+O2↑ | |
| B. | SO2在阴极与O2反应生成硫酸根,则方程式为SO2+O2+2e-=SO42- | |
| C. | 阳极失去2mol电子时,理论上可以得到标准状况下11.2L氧气 | |
| D. | CO2不参与电极反应,净化器中CO2浓度升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X为O,则Y、X形成的常见化合物一定是离子化合物 | |
| B. | 若X是Na,则Z的最高正价一定是偶数 | |
| C. | 若Y为O,则非金属性:X<Y<Z | |
| D. | 若Y为Na,则X、Z不可能是同一主族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 种 | B. | 9 种 | C. | 10 种 | D. | 12 种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24 LSO2中所含氧原子数为0.2NA | |
| B. | 将1 mol Cl2通入水中,HC1O、Cl-、ClO-粒子数之和为2NA | |
| C. | 1 mol NO2与足量H2O反应,转移的电子数为NA | |
| D. | 0.1 mol熔融的NaHSO4中阳离子数目为0.lNA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(K) | 平衡时NH3的物质的量(mol) |
| T1 | 2.4 |
| T2 | 2.0 |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com