


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 在实验室,可以用如图所示的装置制取乙酸乙酯.回答下列问题:
在实验室,可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al 1s22s22p63s23p1 |
| B、S2- 1s22s22p63s23p4 |
| C、Na+ 1s22s22p6 |
| D、F 1s22s22p5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若满足:c(Cl-)=c(NH4+)>c(OH-)=c(H+),则溶质一定是NH4Cl |
| B、若满足:c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶质一定是NH4Cl和NH3-?H2O |
| C、溶液中四种离子之间可能满足:c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D、若满足:c(NH4+)=c(Cl-),则溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
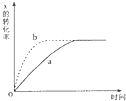 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s) 进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A、缩小容器的容积 |
| B、升高温度 |
| C、加大X的投入量 |
| D、增大容器的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 放电 |
| 充电 |
| A、电池充电时,Ni(OH)2只作为阴极上反应的原料 |
| B、该反应属于可逆反应 |
| C、电池充电时,氢元素被还原 |
| D、电池放电时,H2是负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com