
| A. | 由于硅处于金属与非金属的过渡位置,故硅可用作半导体材枓 | |
| B. | 由于F元素的最低化合价为-1价,故F元素的最高化合价为+7价 | |
| C. | 由于分子中氢原子数:H2SO4>HClO4,故酸性:H2SO4>HClO4 | |
| D. | 由于H2S的相对分子质量大于H2O的相对分子质量,所以沸点前者大于后者 |
分析 A.硅处于金属与非金属的过渡位置,为可导电的非金属;
B.F无正价;
C.酸性的强弱与H原子的个数无关;
D.H2O分子间可形成氢键,沸点较高.
解答 解:A硅处于金属与非金属的过渡位置,为可导电的非金属,可用作半导体材枓,故A正确;
B.F的非金属性最强,无正价,故B错误;
C.H2SO4、HClO4都为最高价氧化物的水化物,酸性的强弱与非金属性的强弱有关,非金属性越强,酸性越强,与H原子的个数无关,故C错误;
D.H2O分子间可形成氢键,作用力大于范德华力,沸点较高,故D错误.
故选A.
点评 本题考查元素周期律知识,为高考常见题型,侧重于学生的分析能力和基本概念的理解和运用的考查,注意元素的性质与对应单质、化合物的关系,把握元素周期律的递变规律是解答该类题目的关键,难度不大.


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | LiH、LiD、LiT互为同素异形体 | |
| B. | LiH、LiD、LiT中氢元素的化合价均为+1 | |
| C. | H、D、T互为同位素 | |
| D. | H、D、T的物理性质与化学性质都相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4和NH4+是等电子体,键角均为60° | |
| B. | B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道 | |
| C. | H3O+和PCl3是等电子体,均为三角锥形结构 | |
| D. | NO3-和CO32-是等电子体,均为平面正三角形结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
| E | 基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |
 ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池的示意图.下列说法错误的是( )
H2S是一种剧毒气体,对H2S废气资源化利用途径之一是回收能量并得到单质硫,反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l)△H=-632kJ•mol-1.下图为质子膜H2S燃料电池的示意图.下列说法错误的是( )| A. | 电池工作时,电子从电极a经负载流向电极b | |
| B. | 实际工作中当反应生成64gS2时,电池内部释放632kJ电能 | |
| C. | 电极a上发生的电极反应为:2H2S-4e-=S2+4H+ | |
| D. | 当电路中通过4mol电子时,有4mol H+经质子膜进入正极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 400mL 1mol/L稀硝酸与Fe完全反应(还原产物只有NO),转移电子的数目为0.3NA | |
| B. | 含有0.1 mol NH4+的氨水中,含有OH-的数目为0.1 NA | |
| C. | 标准状态下,33.6 L氟化氢中含有1.5 NA个氟化氢分子 | |
| D. | 30 g乙酸和乙酸乙酯的混合物完全燃烧,消耗O2的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
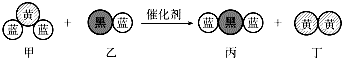
| A. | 若蓝、黑球原子的相对质量之比为4:3,则乙、丙两物质的摩尔质量之比为7:11 | |
| B. | 若乙丙中蓝球元素显相同负价,则乙中黑球元素失去电子,被氧化 | |
| C. | 若甲中黄球元素显正价,则丁为还原产物 | |
| D. | 化学方程式中乙、丁的化学计量数均为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com