
| A. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键 | |
| B. | 己烷和苯可以用酸性高锰酸钾溶液鉴别 | |
| C. | 甲烷和氯气反应生成一氯甲烷,苯和氢气反应生成环己烷,二者反应类型相同 | |
| D. | 在水溶液里,乙酸分子中的-CH3可以电离出H+ |
分析 A.苯如果含有碳碳双键,则苯能和溴发生加成反应;
B.苯、烷烃性质都较稳定,二者和酸性高锰酸钾溶液都不反应;
C.甲烷和氯气发生取代反应生成一氯甲烷,苯和氢气发生加成反应生成环己烷;
D.在水溶液里乙酸羧基能电离出氢离子.
解答 解:A.苯如果含有碳碳双键,则苯能和溴发生加成反应,苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键,故A正确;
B.苯、烷烃性质都较稳定,二者和酸性高锰酸钾溶液都不反应,所以现象相同,无法鉴别,故B错误;
C.甲烷和氯气发生取代反应生成一氯甲烷,苯和氢气发生加成反应生成环己烷,前者是取代反应、后者是加成反应,反应类型不同,故C错误;
D.在水溶液里乙酸羧基能电离出氢离子,甲基不能大量出氢离子,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,涉及物质结构判断、物质鉴别、反应类型判断等知识点,明确物质结构、性质差异性是解本题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 可用湿润的淀粉碘化钾试纸检验产物Q | |
| B. | K2FeO4在水中的电离方程式为K2FeO4→2K++Fe6++4O2一 | |
| C. | 反应中氧化剂与还原剂的物质的量之比为1:3 | |
| D. | 反应中涉及的物质中有5种为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| B. | $\frac{{k}_{W}}{c({H}^{+})}$=1×10-13 mol/L的溶液中:NH4+、Na+、SiO32-、Cl- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物的秸秆、枝叶、杂草和人畜粪便等生物质在沼气池中经发酵可生成沼气 | |
| B. | Al(OH)3、Fe(OH)3等胶体具有很强的吸附能力,可用于净水 | |
| C. | 鸡蛋清中加入浓食盐水析出沉淀、75%乙醇溶液进行消毒、福尔马林用于浸制生物标本,其中蛋白质都发生了变性 | |
| D. | 塑料袋、废纸、旧橡胶制品等属于有机物,可以回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 食品化学家A.Saari Csallany和Christine Seppanen说,当豆油被加热到油炸温度(185℃)时,会产生如图所示高毒性物质,许多疾病和这种有毒物质有关,如帕金森症.下列关于这种有毒物质的判断正确的是( )
食品化学家A.Saari Csallany和Christine Seppanen说,当豆油被加热到油炸温度(185℃)时,会产生如图所示高毒性物质,许多疾病和这种有毒物质有关,如帕金森症.下列关于这种有毒物质的判断正确的是( )| A. | 该物质分子中含有两种官能团 | |
| B. | 该物质的分子式为C9H15O2 | |
| C. | 1mol该物质最多可以和2molH2发生加成反应 | |
| D. | 该物质不能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
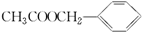 )是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: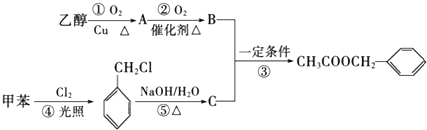
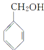 ,B中含氧官能团的名称是羧基.
,B中含氧官能团的名称是羧基.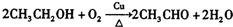 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
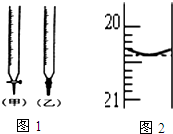 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com