
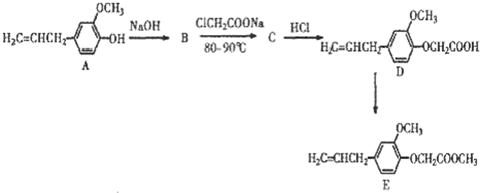
 ,B与ClCH2C00Na反应生成C,C酸化生成D,根据D的结构简式,则C为
,B与ClCH2C00Na反应生成C,C酸化生成D,根据D的结构简式,则C为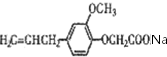 ,据此分析解答.
,据此分析解答. ,B与ClCH2C00Na反应生成C,C酸化生成D,根据D的结构简式,则C为
,B与ClCH2C00Na反应生成C,C酸化生成D,根据D的结构简式,则C为 ,
, ,C为
,C为 ,则B→C是B与ClCH2C00Na发生的取代反应;B的结构简式是
,则B→C是B与ClCH2C00Na发生的取代反应;B的结构简式是 ,故答案为:取代反应;
,故答案为:取代反应; .
. ,
, ;
;


科目:高中化学 来源: 题型:
| A、在28 g乙烯、丙烯和聚乙烯树脂的混合物中,含有的碳原子数目为2NA |
| B、标况下,23g乙醇分子中含有共用电子对数为4NA |
| C、由两种短周期元素X和Y可组成化合物XaYb,当X的原子序数为m时,Y的原子序数可能为:m+8-a-b;m+16-a-b;m-a-b |
| D、同主族元素原子序数差可能为8、18、26、37 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若m+n<p,温度不变,将容器体积缩小到原来的一半,则X的浓度大于原来的2倍 |
| B、若在密闭恒温容器中加入pmol的Z达到平衡,再加入一定量的Z,Z的百分比含量不变,则m+n=p |
C、若定温下Y的体积分数(Y%)与压强变化的关系如图所示,则a点表示平衡正向移动且反应速率:a点<b点 |
| D、若m+n=p,且在密闭恒容容器内进行,当温度升高时,平衡逆向移动,容器中气体的压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和的食盐水中通气体的最合适的方法是先通CO2,再通NH3 |
| B、该反应能发生的原因是NaHCO3的溶解度在几种物质中最小 |
| C、若制得的”碱“中混有少量的NaHCO3,应用过量的NaOH溶液除去 |
| D、用酚酞试液可鉴别制得”碱“液和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验.
为探究铜与稀硝酸反应的产物及影响反应速率的主要因素,进行如下实验.| 间/min | 现象 |
| 0~15 | 铜表面出现气泡,但速度很慢 |
| 25 | 溶液有很浅的蓝色,气泡生成速度加快 |
| 30 | 气泡生成速度较快,均匀冒出 |
| 45 | 洗气瓶中可见少量淡棕色的物质 |
| 50 | 溶液中蓝色明显变深,洗气瓶中突显明显棕色 |
| 序号 | 温度 | 铜片/g | 硝酸/mL | 硝酸铜/g |
| 1 | 25℃ | ① | ② | ③ |
| 2 | 25℃ | 5 | 20 | 0.5 |
| 3 | 25℃ | 5 | 20 | 1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
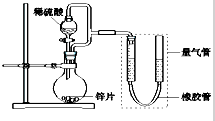 某同学设计如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.
某同学设计如图所示装置(部分夹持装置已略去),该装置可以用来进行多项实验研究.| 序号 | V(H2SO4)/ml | C(H2SO4)/mol?L-1 | t/s |
| Ⅰ | 40 | 1 | t1 |
| Ⅱ | 40 | 4 | t2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、F2 K HCl |
| B、Cl2 Al H2 |
| C、NO2 Na Br2 |
| D、O2 SO2 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com