
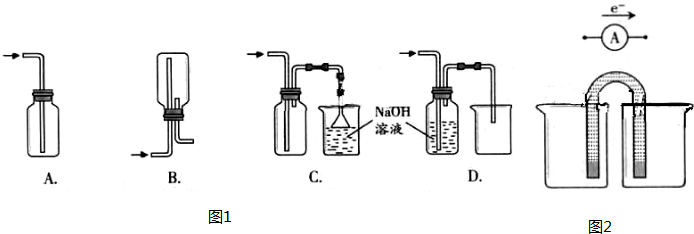
部分金属可以与水在一定条件下发生反应。
(1)将一小块金属钠投入盛有水的烧杯中,待完全反应后,向其中滴加酚酞溶液。①钠与水反应的化学方程式是 。
②上述实验过程中,可观察到的实验现象有 (填选项序号),
产生现象b的原因是 。
a.钠浮在水面 b.钠熔成小球
c.钠球在水面上四处游动,发出嘶嘶声,逐渐消失
d.反应后向烧杯中滴加酚酞溶液,溶液呈红色
(2)铁粉可以与水蒸气在高温下反应,生成 (填化学式)和氢气。
(1)①2Na + 2H2O == 2NaOH + H2↑ ②a b c d 反应放出大量的热,钠的熔点较低(2)Fe3O4
【解析】
试题分析:(1)钠与水反应的化学方程式是①2Na + 2H2O == 2NaOH + H2↑。②由于Na的密度比水小,所以浮在水面上;由于Na的熔点低,Na与水的反应又是放热反应,反应放出的热是Na熔化,所以钠熔成小球;Na与水反应产生氢气,氢气泡破裂产生嘶嘶声,由于Na球受到的各个方向的力大小不等,所以在水面上四处游动; Na与水反应产生NaOH,使溶液显碱性,滴加酚酞试剂,溶液变为红色。(2)铁粉可以与水蒸气在高温下反应,方程式为3Fe+4H2O(g)  Fe3O4+4H2↑。可见反应产物有Fe3O4和氢气。
Fe3O4+4H2↑。可见反应产物有Fe3O4和氢气。
考点:考查金属Na、Fe与水反应的条件、现象及反应产物、方程式的书写的知识。


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||


查看答案和解析>>
科目:高中化学 来源: 题型:
| 乙醚 | 室温 |
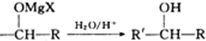 +Mg(OH)X
+Mg(OH)X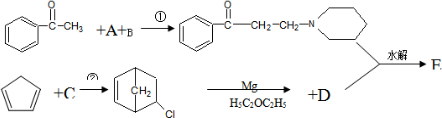
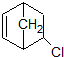 中手性碳原子数为
中手性碳原子数为查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
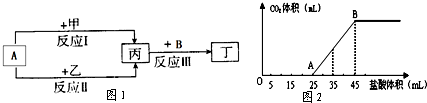
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com