
(1)已知25℃时几种物质(溶液浓度为0.1mol/L)的电离度如下表:(电离度:弱电解质已电离的分子的物质的量占分子总物质的量的百分数)(已知:H2SO4的第一步电离是完全的)
| ①H2SO4溶液中的HSO | ②NaHSO4溶液中的HSO | ③CH3COOH | ④HCl |
| 10% | 29% | 1.33% | 100% |
i25℃时,0.1mol/L上述几种溶液c(H+)由大到小的顺序是(填序号) .
ii25℃时,将足量的Zn粉放入等体积、pH=1的上述几种溶液中,产生氢气的体积(同温同压下)由大到小的顺序是(填序号) .
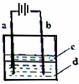 (2)由于Fe(OH)2极易被氧化,所以实验室难以用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置,可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(2)由于Fe(OH)2极易被氧化,所以实验室难以用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用下图所示实验装置,可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
i a电极材料为 ,其电极反应式为 ;
电解过程中,b极附近溶液pH= (增大、减小、不变),
试用必要的文字说明原因 。
ii d电解液是 时,电解片刻后,装置中可见Fe(OH)2白色沉淀。
A.稀硫酸 B.NaCl溶液
C.NaOH溶液 D.CuCl2溶液
iii 装置中液体c的作用是 。
科目:高中化学 来源: 题型:
| ①硫酸溶液 | ②硫酸氢钠溶液 | ③醋酸溶液 | ④盐酸 |
| HSO4-?H++SO42- | HSO4-?H++SO42- | CH3COOH?CH3COO-+H+ | HCl=H++Cl- |
| 10% | 29% | 1.33% | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
(2010?陕西模拟)已知25℃时几种弱酸的电离平衡常数:
|
查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)已知25℃时几种物质的电离度(溶液浓度均为0.1mol/L) 如下表(已知硫酸的第一步电离是完全的):
| ①硫酸溶液 | ②硫酸氢钠溶液 | ③醋酸溶液 | ④盐酸 |
| HSO4- | HSO4- | CH3COOH | HCl = H++Cl- |
| 10℅ | 29℅ | 1.33℅ | 100℅ |
⑴根据题意,请写出向硫酸溶液中滴加足量氢氧化钡溶液反应的离子反应方程式
⑵25℃时,0.1mol/L上述几种溶液中C(H+)由大到小的顺序是 (填序号,下同);
⑶25℃时,将足量锌粉放入等体积pH=1的上述几种溶液中,产生H2的体积(相同状况)由大到小的顺序是 ;
⑷25℃时,0.1mol/L H2SO4中的HSO4-的电离度小于0.1mol/L NaHSO4中HSO4-的电离度的原因是:
查看答案和解析>>
科目:高中化学 来源:2015届江苏省高二上学期期中考试化学试卷(选修)(解析版) 题型:填空题
电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
编号 物质(微粒) 电离度α
A 硫酸溶液(第一步完全电离): 第二步 HSO4- H++SO42- 10%
H++SO42- 10%
B 硫酸氢钠溶液: HSO4- H++SO42 29%
H++SO42 29%
C 醋酸: CH3COOH CH3COO-+H+ 1.33%
CH3COO-+H+ 1.33%
D 盐酸: HCl=H++Cl- 100%
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从大到小的顺序是 (填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠
溶液中HSO4-的电离度,其原因是 。
(3)醋酸的电离平衡常数K的表达式是 ,醋酸的电离平衡常数
K与电离度α的关系式为:K= (用含α的代数式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com