
将一定质量的镁、铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物全部是NO)。向反应后的溶液中加入6mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加7.65g,则下列叙述中正确的是
A.当金属全部溶解时收集到NO气体的体积为3.36L
B.当生成沉淀达到最大量时,消耗NaOH溶液的体积为V≥75ml
C.参加反应的金属的总质量一定是9.9g
D.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.45mol
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学卷(解析版) 题型:选择题
金属铬和氢气在工业上都有重要的用途。已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4)。铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是
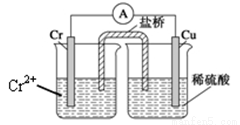
A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论 上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学卷(解析版) 题型:选择题
下列事实,不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后,溶液颜色变浅
B.对2HI(g) H2(g)+I2(g),平衡体系增大压强可使颜色变深
H2(g)+I2(g),平衡体系增大压强可使颜色变深
C.反应CO+NO2 CO2+NO △H<0,升高温度可使平衡向逆反应方向移动
CO2+NO △H<0,升高温度可使平衡向逆反应方向移动
D.合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考四化学卷(解析版) 题型:填空题
Ⅰ. 工业上可通过CO和H2化合制得CH3OH: CO(g)+2H2(g) 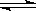 CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
CH3OH(g) ΔH (CO结构式为C≡O)。又知某些化学键的键能(断开 1 mol化学键时所需要的最低能量)数值如下表:
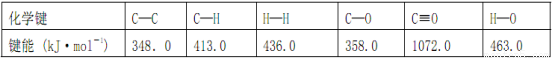
则ΔH =_____________,在相应的反应条件下,将 1 mol CO(g)与足量H2混合充分反应后,则放出或吸收的热量Q ________ ΔH 的数值(填“>”、“=”或“<”)。
Ⅱ.电化学降解NO3-的原理如右图所示。
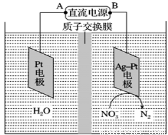
①电源 A 极为________(填“正极”或“负极”),阴极反 应式为_______________。
应式为_______________。
②若电解过程中转移了 1 mol 电子,则膜左侧电解液的质量减少量为________g。
Ⅲ.已知NO2和N2O4的相互转化反应:2NO2(g)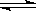 N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:
N2O4(g) ΔH<0。现将一定量NO2和N2O4的混合气体通入一体积为 2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如下图:
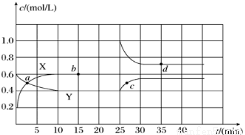

①图中共有两条曲线X和Y,其中曲线________表示NO2浓度随时间的变化。下列不能说明该反应已达到平衡状态的是________。
A. 容器内混合气体的压强不随时间变化而改变
B. 容器内混合气体的密度不随时间变化而改变
C. 容器内混合气体的颜色不随时间 变化而改变
变化而改变
D. 容器内混合气体的平均分子量不随时间变化而改变
②前 10 min内用NO2表示的化学反应速率v(NO2)=________mol/(L·min) 。
。
③反应 25 min 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是_____________(用文字表达);其平衡常数 K(d)________K(b)(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上月考四化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值,下列说法正确的是
A.常温常压 下,32gO2 、O3的混合物含有2Na个氧原子
下,32gO2 、O3的混合物含有2Na个氧原子
B.6.8g熔融的KHSO4中含有0.1NA个阳离子
C.1L1mol/L的盐酸溶液中含HCl分子数为1NA
D.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2NA
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟一化学试卷(解析版) 题型:选择题
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。对下列实验事实的解释错误的是
| 现 象 | 解释或结论 |
A | SO2使酸性高锰酸钾溶液褪色 | SO2表现漂白性 |
B | 浓硝酸在光照条件下变黄 | 浓硝酸不稳定,生成有色物质且能溶于浓硝酸 |
C | 向饱和Na2CO3中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
D | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色。 | Fe3+的氧化性比I2的强 |
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上模拟一化学试卷(解析版) 题型:选择题
关于下列各装置的叙述,正确的是
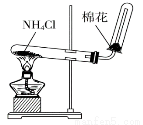

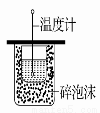
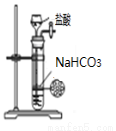
① ②  ③ ④
③ ④
A.装置①可用于制取氨气
B.装置②可用于吸收尾气中少量NH3或HCl,并防止倒吸
C.装置③可用于测定中和热
D.装置④可用于制备少量二氧化碳
查看答案和解析>>
科目:高中化学 来源:2017届江西师大附中高三上学期期中化学试卷(解析版) 题型:选择题
下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入到含1 2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-=HClO+HSO | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合: 2AlO |
|
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省娄底市等五校高二上期中化学卷(解析版) 题型:选择题
反应CO(g)+H2O(g)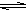 CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1,在800℃时的化学平衡常数K=1.0 。某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
此时反应中正、逆反应速率的关系式是
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com