
���� ��1��������֪�Ȼ�ѧ����ʽ��˹���ɼ��㣬�ɸ�˹���ɢ١�2-�ڡ�2+�ۡ�3�õõ���Ӧ���ʱ䣬д����Ӧ��Ӧ���Ȼ�ѧ����ʽ��
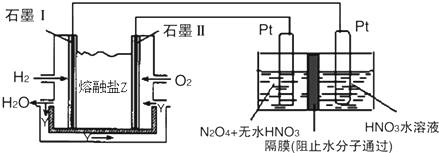
��2��ȼ��ԭ����У�������ȼ��ʧ���ӷ���������Ӧ��������ȼ��ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ���ȸ��ݻ��ϼ��ж�����N2O5�ĵ缫��N2O5�е�Ԫ�صĻ��ϼ���+5�ۣ��������е�Ԫ��Ҳ��+5�ۣ����Ӧ�����������N2O5�����������������ɣ��ٸ������ӵķŵ�˳��д���缫��Ӧʽ��
��3���ö��Ե缫��ⱥ��NaCl��Һʱ��CH3OH-6e-+8OH-=CO32-+6H2O��ÿ����0.2mol CH3OH��ת�Ƶ���1.2mol�������缫��ӦΪ2H++2e-=H2��������ת��Ϊ1.2mol����Ӧ���������ʵ���Ϊ0.6mol���ݴ˼����״��������������
��� �⣺��1��N2��g��+O2��g���T2NO��g����H=+180.5kJ/mol ��
N2��g��+3H2��g���T2NH3��g����H=-92.4kJ/mol ��
2H2��g��+O2��g���T2H2O��g����H=-483.6kJ/mol ��
�ɸ�˹���ɢ١�2-�ڡ�2+�ۡ�3�ã�4NH3��g��+5O2��g���T4NO��g��+6H2O��g����H=905.0kJ/mol��
�ʴ�Ϊ��4NH3��g��+5O2��g��=4NO��g��+6H2O��g����H=-905.0kJ/mol��
��2��ȼ��ԭ����У�������ȼ��ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ���缫��ӦʽΪH2+CO32--2e-=CO2+H2O��
N2O5�е�Ԫ�صĻ��ϼ���+5�ۣ��������е�Ԫ��Ҳ��+5�ۣ����Ӧ�����������N2O5�����������������ɣ��ݵ缫��Ӧ���ӷŵ�˳���֪����������2H++2e-=H2���ķ�Ӧ��������ΪN2O4+2HNO3-2e-=2N2O5+2H+��
�ʴ�Ϊ��H2+CO32--2e-=CO2+H2O��N2O4+2HNO3-2e-=2N2O5+2H+��
��3���øõ������Դ���ö��Ե缫��ⱥ��NaCl��Һʱ��CH3OH-6e-+8OH-=CO32-+6H2O��ÿ����0.2mol CH3OH��ת�Ƶ���1.2mol�������缫��ӦΪ2H++2e-=H2���������������������=0.6mol��22.4L/mol=13.44L��
�ʴ�Ϊ��13.44��
���� ������Ҫ�����˸�˹���ɡ����صĹ���ԭ��֪ʶ��ԭ���ԭ����������㣬�Ѷ��еȣ�����ݻ��ϼ۵ı仯ȷ������N2O5�ĵ缫���������ӵķŵ�˳��д����Ӧ�ĵ缫��Ӧʽ�����ջ����ǹؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Զ��ױ� | B�� | �����ױ� | C�� | ��������� | D�� | �Ҷ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Hԭ���γ�1 mol H-H��Ҫ�������� | |
| B�� | ����ȼ�յķ�Ӧ���Ƿ��ȷ�Ӧ | |
| C�� | NaOH����ˮ�Ƿ��ȷ�Ӧ | |
| D�� | ���ȷ�Ӧ���������͵ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ��ϩ | C�� | ���� | D�� | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 =CH-CHO�����з�Ӧ��Ϣ��
=CH-CHO�����з�Ӧ��Ϣ�� +CO$��_{�Ȼ���}^{HCl}$
+CO$��_{�Ȼ���}^{HCl}$

 ��
�� ��
�� ������֮һ����
������֮һ���� $��_{����1}^{G}$H$\stackrel{Ũ����}{��}$
$��_{����1}^{G}$H$\stackrel{Ũ����}{��}$ =
= ��Ӧ����1��ϡ��Լ�G��CH3CH2CHO��H�Ľṹ��ʽ��
��Ӧ����1��ϡ��Լ�G��CH3CH2CHO��H�Ľṹ��ʽ�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Cl | B�� | CHO | C�� | OH | D�� | COOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 ��
�� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

 +��2n-1��H2O ��Ӧ����Ϊ�ۺϷ�Ӧ��
+��2n-1��H2O ��Ӧ����Ϊ�ۺϷ�Ӧ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com