
【题目】下列不属于氧化还原反应的是( )
A. S+O 2 ![]() SO2
SO2
B. Fe(OH)3+3HCl===FeCl3+3H2O
C. 2Mg+CO2![]() 2MgO+C
2MgO+C
D. 4HNO3(浓)![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如右图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为( )

A. 6:1 B. 3:1 C. 2:1 D. 1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把a,b,c三块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;b、c相连时,c不易被腐蚀。则三种金属的活动性由强到弱的顺序为
A. a>b>c B. a>c>b C. c>b>a D. b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱是重要的化工原料,在医药、冶金、化工、食品等领域被广泛使用。
I. 用纯净的碳酸钠固体配制500mL 0.40mol/L Na2CO3溶液。
(1)称取Na2CO3固体的质量是______________________g。
(2)配制溶液时,进行如下操作,按照操作顺序,第4步是_________(填字母)。
a. 定容 b. 计算 c. 溶解 d. 摇匀 e. 转移 f. 洗涤 g. 称量
(3)下列说法中,正确的是_____________________(填字母)。
a. 定容时,仰视刻度线,会导致配制的溶液浓度偏小
b. 定容时,如果加水超过刻度线,要用滴管吸出
c. 转移时,溶液倒出容量瓶外,要重新配制溶液
d. 摇匀后,液面低于刻度线,要再加水至刻度线
II. 某实验小组的同学模拟侯德榜制碱法制取纯碱,流程如下:

(1)工业生产纯碱的第一步是除去饱和食盐水的中SO42―、Ca2+离子,依次加入的试剂及其用量是 ______________、 _______________、 (过滤)、 _______________。
(2)已知:几种盐的溶解度
NaCl | NH4HCO3 | NaHCO3 | NH4Cl | |
溶解度(20°C,100gH2O时) | 36.0 | 21.7 | 9.6 | 37.2 |
①写出装置I中反应的化学方程式________________________________________。
②写出装置II中发生反应的化学方程式________________________________。
(3)该流程中可循环利用的物质是__________________。
(4)制出的纯碱中只含有杂质NaCl。
①检验用该纯碱配制的溶液中含有Cl―的方法是_________________________。
②测定该纯碱的纯度,下列方案中可行的是__________(填字母)。
a. 向m克纯碱样品中加入足量CaCl2溶液,沉淀经过滤、洗涤、干燥,称其质量为b g
b. 向m克纯碱样品中加入足量稀盐酸,用碱石灰(主要成分是CaO和NaOH)吸收产生的气体,碱石灰增重b g
c. 向m克纯碱样品中加入足量AgNO3溶液,产生的沉淀经过滤、洗涤、干燥,称其质量为b g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于pH=3的CH3COOH溶液的叙述正确的是
A. 溶液中H2O电离出的c(OH)=1.0×103 mol·L1
B. 加入少量CH3COONa固体后,溶液pH升高
C. 加0.1 mol·L1 CH3COONa溶液使pH>7,则c(CH3COO)=c(Na+)
D. 与等体积pH=11的NaOH溶液混合,所得溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中都属于弱电解质的一组是
A. NH3、SO2、H2O、HI
B. HF、H2O、NH3·H2O、H2SO3
C. BaSO4、Cl2、HClO、H2S
D. NaHSO3、H2O、CO2、H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车净化的主要原理为2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
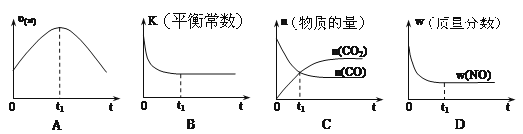
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究性学习实验小组做了如下实验:
实验一:利用H2C2O4 溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 试验温度/K | 溶液颜色褪至无色时所需时间/s | |||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 2 | 0.02 | 5 | 0.1 | 3 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313 | 2 | 0.02 | V2 | 0.1 | 5 | t1 |
(1)通过实验A、B,可探究出_____________ (填外部因素)的改变对反应速率的影响,其中V1=__________,T1=__________;通过实验__________可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由此实验可以得出的结论是_______________;利用实验B 中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4span>)= __________。
实验二:探究酸的强弱对酸与镁条反应速率的影响。
实验步骤:


(a)检查装置的气密性后,添加药品;
(b)反应开始后,每隔1min记录一次生成H2的体积;
(c)将所记录的数据转化为曲线图(上图乙)。
(3)根据反应的图像(图乙)分析:0-lmin盐酸与镁反应比1-2min反应快的原因:_____________。
(4)对照实验:用20mL水代替酸进行实验。
实验现象:当水滴入锥形瓶中,注射器的活塞_________(填“会”或“不会”)向右移动。
问题分析:针对上述现象,上图中气体发生装置是否合理:_______(填“合理”或“不合理”)若合理,则忽略下问;若不合理,请改进上述装置使其变成合理的装置图:_____________ (用必要的文字或装置图进行回答)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com