

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
分析 蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成,酸溶过滤得到滤液中为Mg2+、Fe3+、Al3+,加入氢氧化钙沉淀得到氢氧化铝、氢氧化铁沉淀A,滤液中通入二氧化碳生成氢氧化铝沉淀B和碳酸氢钙,加入氢氧化钙反应生成碳酸钙循环利用,溶液中得到碳酸氢镁溶液,热解得到碱式碳酸镁.
(1)蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成,蛇纹石加盐酸溶解后,MgO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解;
(2)控制溶液的pH=7~8,此时得到的沉淀A为Al(OH)3、Fe(OH)3,加Ca(OH)2需将溶液的pH控制在7~8,若pH过高,会导致生成的Al(OH)3发生反应Al(OH)3+OH-=AlO2-+2H2O溶解;
(3)红色氧化物为Fe2O3,应先将其中含有的少量Al(OH)3除去,除去Al(OH)3的方法是利用它能溶于强碱的性质.
解答 解:(1)蛇纹石加盐酸溶解,MgO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去,故答案为:Fe3+、Al3+;
(2)由(1)知,此时溶液中除了Mg2+外,还含有Fe3+、Al3+杂质,需除去Fe3+、Al3+但不能损失Mg2+,因Fe3++3H2O?Fe(OH)3+3H+和Al3++3H2O?Al(OH)3+3H+,利用平衡移动的原理,消耗H+使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,加Ca(OH)2需将溶液的pH控制在7~8,若pH过高,会导致生成的Al(OH)3发生反应Al(OH)3+OH-=AlO2-+2H2O溶解,Mg(OH)2在pH为9.4时开始沉淀,所以碱性增强Mg(OH)2会沉淀,同时Mg2+也因转化为沉淀而损失,
故答案为:Al(OH)3;
(3)从实验步骤图知:沉淀混合物为Fe(OH)3和Al(OH)3,红色氧化物是沉淀物Fe(OH)3分解后得到的Fe2O3,所以得先加碱把Al(OH)3除掉,反应为:Al(OH)3+NaOH=NaAlO2+2H2O,然后过滤洗涤灼烧即可;
故答案为:NaOH;过滤、洗涤、灼烧.
点评 本题主要考查了元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计.


科目:高中化学 来源: 题型:选择题
| A. | C2H2 | B. | C2H4 | C. | C2H6 | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
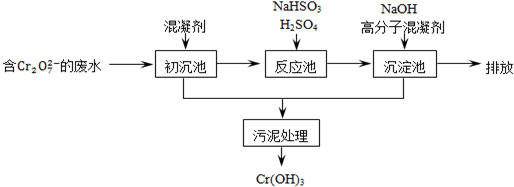
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
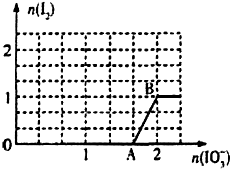 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选 项 | A | B | C | D |
| 物 质 | CaCl2 | H2O2 | H2SO4 | NH4Cl |
| 所含化学键类型 | 离子键、共价键 | 共价键 | 离子键 | 离子键、共价键 |
| 所属化合物类型 | 离子化合物 | 共价化合物 | 离子化合物 | 共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com