
| A、酸性:H4SiO4<H3PO4<H2SO4<HClO4 |
| B、氢化物的稳定性:CH4<NH3<H2O<HF |
| C、碱性:KOH>Ca(OH)2>Mg(OH)2 |
| D、沸点:HI>HBr>HCl>HF |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、②③⑥ | B、②③④ |
| C、④⑤⑥ | D、①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2的热值(单位质量的燃料完全燃烧时所放出的热量,叫做燃料的热值)为142.9kJ?g-1,则氢气燃烧的热化学方程式可表示为:2H2(g)+O2(g)=2H2O(l)△H=-285.8kJ?mol-1 |
| B、反应A(g)═2B(g),若正反应的活化能为Ea kJ?mol-1,逆反应的活化能为Eb kJ?mol-1,则△H=(Ea-Eb)kJ?mol-1 |
| C、能自发进行的化学反应,一定是△H<0、△S>0 |
| D、增大反应物浓度,可增大单位体积内活化分子百分数,从而增加有效碰撞的次数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由N和H形成1 mol NH3所放出的能量 |
| B、把1 mol NH3中的共价键全部拆开所吸收的能量 |
| C、拆开约6.02×1023个N-H键所吸收的能量 |
| D、形成1个N-H键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、106.5g |
| B、10.65g |
| C、42.6g |
| D、8.52g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯、乙烯都能因反应而使溴水褪色 |
| B、等质量的甲烷、乙烯、乙炔充分燃烧,消耗氧气的量由少到多 |
C、CH3CH2OH、 、CH3COOH电离出H+的能力由弱到强 、CH3COOH电离出H+的能力由弱到强 |
| D、蔗糖和福尔马林与新制氢氧化铜悬浊液共热,都产生红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
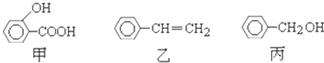
| A、甲、乙、丙都能发生加成反应、取代反应 |
| B、丙与C6H5OH都含有-OH,质谱图显示的质荷比最大值相差14,但不属于同系物 |
| C、淀粉、油脂、有机玻璃等都属于高分子化合物 |
| D、乙的化学名称为苯乙烯,能使溴水褪色,但不存在顺反异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com