
| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
科目:高中化学 来源: 题型:选择题
| A. | HA是强酸 | |
| B. | 混合液中,c(HA)+c(A-)=0.4mol•L-1 | |
| C. | 混合液中,c(Na+)+c(H+)=$\frac{Ka(HA)•c(HA)+Kw}{c({H}^{+})}$ | |
| D. | 向混合液中加入蒸馏水,c(A-)与c(HA)的比值将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | L电子层不包含d亚层 | |
| B. | s 电子绕核旋转,其轨道为一圆圈,而p电子是走∞字形 | |
| C. | 主量子数为1时,有自旋相反的两条轨道 | |
| D. | 主量子数为3时,有3s、3p、3d、3f四条轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2使品红、酸性高锰酸钾溶液褪色,均体现SO2的漂白性 | |
| B. | 完全由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 元素周期表有18列,就有18个族 | |
| D. | SO2的水溶液能导电,所以SO2是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn与稀硫酸反应制取H2时,加入少量硫酸铜 | |
| B. | Al和稀硫酸反应制取H2时,将稀硫酸换成浓硫酸 | |
| C. | 石灰石与稀盐酸反应生成CO2时,将石灰石粉碎 | |
| D. | 用KClO3固体分解制取O2时,固体中添加少量MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A. | 该反应的正反应是吸热反应 | |
| B. | 该反应达到平衡后,保持容器体积不变升高温度,正反应速率不变,容器内混合气体的压强不变 | |
| C. | 830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻υ正<υ逆 | |
| D. | 830℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是60% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
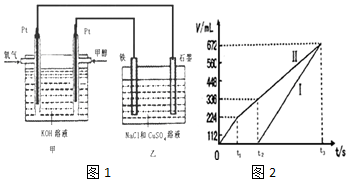
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com