
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
分析 (1)表格中的NH4+水解显酸性,PM2.5的酸碱性为酸性.试样的pH值根据溶液中电荷守恒和水的离子积常数计算;
(2)①已知:ⅠH2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
ⅡC(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol
利用盖斯定律计算反应热,将Ⅱ-Ⅰ可得C(s)+H2O(g)=CO(g)+H2(g);
②依据二氧化硫的性质:是一种酸性氧化物可以和碱反应,二氧化硫溶于水得亚硫酸,酸性强于碳酸,所以可以和碳酸钠溶液反应;
(3)①计算出平衡时各种物质的物质的量,结合平衡常数的表达式计算,依据化学反应速率和平衡移动原理分析判断;
②根据G=△H-T•△S判断反应能否自发进行;
③CO和NO催化氧化生成氮气和二氧化碳.
解答 解:(1)NH4+水解显酸性,PM2.5的酸碱性为酸性;根据电荷守恒有:c(K+)+c(H+)+c(Na+)+c(NH4+)=c(OH-)+2c(SO42-)+2 c(NO3-)+cCl-),而c(OH-)•c(H+)=10-14,代入计算可得:c(OH-)=10-10mol/L,c(H+)=10-4 mol/L,则PH=4;
故答案为:酸性;4;
(2)①已知:ⅠH2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8KJ/mol
ⅡC(s)+$\frac{1}{2}$O2(g)=CO(g)△H=-110.5KJ/mol
利用盖斯定律计算反应热,将Ⅱ-Ⅰ可得C(s)+H2O(g)=CO(g)+H2(g)H=+131.3KJ/mol;
故答案为:C(s)+H2O(g)=CO(g)+H2(g)H=+131.3KJ/mol;
②二氧化硫是酸性氧化物所以具有酸性氧化物的通性能够与碱反应:SO2+Ca(OH)2=CaSO3↓+H2O;二氧化硫水溶液是亚硫酸所以也能够与碳酸钠反应:SO2+Na2CO3=Na2SO3+CO2↑所以可以用氢氧化钙溶液和碳酸钠溶液做洗涤剂;二氧化硫与氯化钙溶液不反应,且在亚硫酸氢钠溶液中的溶解度很小,所以不能用氯化钙和亚硫酸氢钠溶液做洗涤液;
故答案为:ab;
(3)①令容器体积为1L,列三段式:
N2(g)+O2(g)?2NO(g)
c始:0.8 0.2
c转:4×10-4 4×10-4 8×10-4
c平:0.8-4×10-4 0.2-4×10-4 8×10-4
代入K=$\frac{{c}^{2}(NO)}{c({N}_{2})•c({O}_{2})}$≈4×10-6;这是个吸热反应,温度升高,反应速率加快,平衡向正方向移动,单位时间内产生的NO多;
故答案为:4×10-6;因为该反应为吸热反应,温度越高,反应速率加快,平衡右移;
②该反应是个气体体积减小的反应,△S<0,又△H>0,由△G=△H-T△S,任何温度下均不自发进行;
故答案为:该反应是焓增,熵减的反应,任何温度下均不自发进行;
③产物为N2和CO2才无污染:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2;
故答案为:2CO+2N$\frac{\underline{\;催化剂\;}}{\;}$2CO2+N2.
点评 本题考查了pH值的计算、盖斯定律求反应热、化学平衡常数的计算、反应进行方向的判断,题目综合性非常强,涉及知识点多,难度中等,同时又结合了环境的污染和治理,题目又比较新颖,是高考的热门话题,解题时应该结合相应的知识,认真解答.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4含有NA个分子 | |
| B. | 0.1mol/L的HNO3中有0.1NA个H+ | |
| C. | 常温常压下,8gO2含有4NA个电子 | |
| D. | 1molNa被完全氧化生成Na+,失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与电源正极相连的是电解槽的阴极 | |
| B. | 与电源负极相连的电极发生还原反应 | |
| C. | 在电解槽的阳极发生氧化反应 | |
| D. | 电子从电源的负极沿导线流入阴极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H
(1)已知可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)△H
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

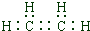 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
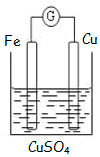 如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.
如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为Zn-2e-=Zn2+;如果将Zn换成Pt,一段时间后,在铁电极区滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,烧杯中的现象是产生蓝色沉淀,发生的反应的离子方程式是3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com