
������������Դ���������й㷺��;������(Ni)�������缫���ŨNaOH��Һ�Ʊ���������Na2FeO4��װ����ͼ��ʾ�������ƶϺ�������( )

A�������������缫��ӦΪFe��6e����4H2O=FeO42 ���� 8H��
B�����ʱ���ӵ���������Ϊ��������Ni�缫����Һ��Fe �缫������
C������ĤΪ�����ӽ���Ĥ����OH�����������ƶ�
D�����ʱ������pH���͡�������pH���ߣ���ȥ��Ĥ��Ϻ���ԭ��Һ�Ƚ�pH����(������ǰ������仯���Բ���)

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲����У�����о����һ����ѧ���Ի�ѧ���������棩 ���ͣ�ѡ����
���˶�Ա�������ʱ����ҽ�漴���˶�Ա�����˲�λ����ҩ��������(��ѧʽΪC2H5Cl���е�Ϊ12.3 ��)�����оֲ��䶳�������������й����������˵���������
A������������̼���⡢������Ԫ����ɵĻ�����
B������������2��̼ԭ�ӡ�5����ԭ�Ӻ�1����ԭ�ӹ��ɵ�
C�������������䶳��������е�ϵͣ��ӷ������й�
D����������̼���⡢������Ԫ�ص�������Ϊ48��10��7l
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�ܿ��и�һ����ĩ��ѧ�Ծ��������棩 ���ͣ������
�Ӻ�ˮ����ȡ��Ĺ�ҵ������ͼ��
��1�����ϲ���I���ѻ������̬���壬����II�ֽ�֮ת��ɻ���̬���壬��Ŀ���� ��
��2�������ͨ���ȿ�����ˮ��������Br2,��������� ��
A.������ B.��ԭ�� C.�ӷ��� D.��ʴ��
��3���������̢����漰�����ӷ�Ӧ���£��������淽���������ʵ��Ļ�ѧ����������Ӧ���ʣ�
��Br2 + ��CO32- ��BrO3��+ ��Br��+ ��
��BrO3��+ ��Br��+ ��
��4�����������д������������� Ҳ�����ö�������ˮ��Һ���գ�������������������д�������������ˮ��Һ��Ӧ�Ļ�ѧ����ʽ: ��
��5��ʵ���ҷ����廹�������ܼ���ȡ�������п������������ȡ������ ��
A.�Ҵ� B.���Ȼ�̼ C.�ռ���Һ D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����ʡ�ܿ��и�һ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��ˮ(D2O)����Ҫ�ĺ˹�ҵԭ�ϣ�����˵��������� �� ��
A. 뮣�D)ԭ�Ӻ�����1������ B. H��D����ͬλ��
C. H2O��D2O����ͬ�������� D. 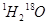 ��D216O����Է���������ͬ
��D216O����Է���������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶�8���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
H2S������Դ������;��֮һ�ǻ����������õ�������Ӧԭ��Ϊ��2H2S��g��+O2��g���TS2��s��+2H2O��l����H=��632kJ•mol��1����ͼΪ����ĤH2Sȼ�ϵ�ص�ʾ��ͼ������˵����ȷ���ǣ� ��
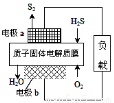
A���缫aΪ��ص�����
B���缫b�Ϸ����ĵ缫��ӦΪ��O2+2H2O+4e��=4 OH��
C����·��ÿ����4mol���ӣ�����ڲ��ͷ�632kJ����
D��ÿ17gH2S���뷴Ӧ����1mol H+������Ĥ����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶�8���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�������أ��ŵ�ʱ���ܷ�ӦΪ��Fe+Ni2O3+3H2O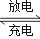 Fe��OH��2+2Ni��OH�� 2�����йظõ�ص�˵������ȷ���ǣ� ��
Fe��OH��2+2Ni��OH�� 2�����йظõ�ص�˵������ȷ���ǣ� ��
A����صĵ��ҺΪ������Һ������ΪNi2O3������ΪFe
B����طŵ�ʱ��������ӦΪFe+2OH����2e���TFe��OH��2
C����س������У�����������Һ��pH����
D����س��ʱ��������ӦΪ2Ni��OH��2+2OH����2e���TNi2O3+3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ��ӱ�ʡ�߶�8���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��֪298Kʱ���ϳɰ���ӦN2��g��+3H2��g��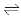 2NH3��g����H=��92.0kJ•mol��1�������¶��µ�1mol N2��3mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ���ٶ�����������û��������ʧ���� ��
2NH3��g����H=��92.0kJ•mol��1�������¶��µ�1mol N2��3mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ���ٶ�����������û��������ʧ���� ��
A��һ������92.0 kJ B����ȷ��
C��һ������92.0 D��һ��С��92.0 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ĸ߶���ѧ�ڿ�ѧ���Ի�ѧ�Ծ��������棩 ���ͣ������
ij�¶�ʱ����2L���ܱ������У�X��Y��Z����Ϊ���壩�������ʵ�����ʱ��ı仯������ͼ��ʾ��
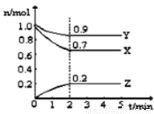
��1����ͼ���������ݽ��з������÷�Ӧ�Ļ�ѧ����ʽΪ ��
��2����Ӧ�ӿ�ʼ��2���ӣ���Z��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊv(Z)= ��
��3��2min��Ӧ��ƽ�������ڻ�������ƽ����Է�����������ʼʱ ��������С�䣩����������ܶȱ���ʼʱ ��������С�䣩��
��4�����д�ʩ�ܼӿ췴Ӧ���ʵ��� ��
A������ʱ����X B����ʱ�����Z C�������¶� D��ѡ���Ч�Ĵ���
��5������˵����ȷ���� ��
A�������¶ȿ��Ըı仯ѧ��Ӧ��ƽ��״̬
B����֪����Ӧ�����ȷ�Ӧ�������¶�ƽ�������ƶ�������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C���ﵽ��ѧ��Ӧ��ƽ��״̬��ʱ�䳤����
D����ѧ��Ӧ��ƽ��״̬�Dz����ܸı��
E������Y��Ũ�ȣ�����Ӧ���ʼӿ죬�淴Ӧ���ʼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�������������ʦ���и�һ�Ͽ�ѧ����ѧ���������棩 ���ͣ�ѡ����
����0.1mol/LH2SO4��Һ������������ǣ� ��
A��1L����Һ�к���H2SO4������Ϊ9.8g
B��0.5L����Һ�������ӵ����ʵ���Ũ��Ϊ0.2mol/L
C����1L����Һ��ȡ��100mL����ȡ����Һ��H2SO4�����ʵ���Ũ��Ϊ0.01mol/L
D��ȡ����Һ10mL����ˮϡ����100mL��H2SO4�����ʵ���Ũ��Ϊ0.01mol/L
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com