
把10.2g 镁铝合金的粉末放入过量的盐酸中,得到11.2L H2(标准状况下).试计算:
(1)该合金中铝的质量分数;
(2)该合金中铝和镁的物质的量之比.
考点: 有关混合物反应的计算.
专题: 计算题.
分析: 标况下11.2L氢气的物质的量为: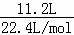 =0.5mol,题中涉及反应方程式有:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,结合反应的方程式及题中数据可列方程式组进行计算.
=0.5mol,题中涉及反应方程式有:Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,结合反应的方程式及题中数据可列方程式组进行计算.
解答: 解:标准状况下,11.2L氢气的物质的量为0.5mol,
Mg+2HCl=MgCl2+H2↑
1 1
n(Mg) n(Mg)
2Al+6HCl=2AlCl3+3H2↑,
2 3
n(Al) 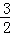 n(Al)
n(Al)
则:n(Mg)×24g/mol+n(Al)×27g/mol=10.2g
n(Mg)+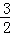 n(Al)=0.5mol
n(Al)=0.5mol
解得:n(Mg)=0.2mol
n(Al)=0.2mol
(1)合金中铝的质量分数为: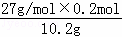 ×100%≈52.9%,
×100%≈52.9%,
答:该合金中铝的质量分数为52.9%;
(2)合金中铝和镁的物质的量之比为:n(Al):n(Mg)=0.2mol:0.2mol=1:1,
答:该合金中铝和镁的物质的量之比为1:1.
点评: 本题考查了有关混合物的简单计算,题目难度中等,注意明确根据化学方程式进行的有关物质的量简单计算方法,能够正确书写出镁、铝与酸反应的化学方程式.


 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案科目:高中化学 来源: 题型:
下列有机物中加入溴水,充分振荡后静置,观察到水层变为无色,有机溶液层为橙黄色,该有机物是()
A. 乙醛 B. 1﹣己烯 C. 1,3﹣丁二烯 D. 苯
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在用稀硫酸与锌反应制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率。请回答下列问题:
(1)上述实验中发生反应的化学方程式有__________________。
(2)硫酸铜溶液可以加快氢气生成速率的原因是____________。
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是________。
(4)要加快上述实验中气体产生的速率,还可采取的措施有________________________________________________________(答两种)。
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验。将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
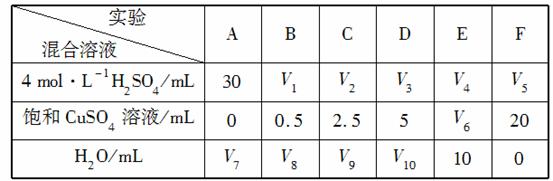
①请完成此实验设计,其中:V1=________,V6=________,V9=________;
②反应一段时间后,实验A中的金属呈________色,实验E中的金属呈________色;
③该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:
___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子能大量共存的是()
A. Cu2+ SO42﹣ Na+ Cl﹣ B. Fe3+ SCN﹣ Cl﹣ K+
C. NH4+ K+ Cl﹣ SO42﹣ D. Fe3+ I﹣ Cl﹣ H+
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按图所示的装置进行电解实验.下列说法正确的是()
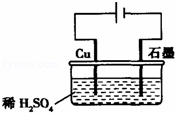
A. 电解过程中,铜电极上有H2产生
B. 电解初期,主要反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C. 电解一定时间后,石墨电极上有铜析出
D. 整个电解过程中,H+的浓度不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
(Ⅰ)在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)═CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t/℃ 700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
回答下列问题:
(1)该反应的化学平衡常数表达式为K==.
(2)该反应为反应(填“吸热”或“放热”).
(3)能判断该反应达到化学平衡状态的依据是BC.
A.容器中压强不变
B.混合气体中C(CO)不变
C.V(H2)正=V(H2O)逆
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:C(CO2)•C(H2)=c(CO)•c(H2O),试判断此时的温度为℃.
(Ⅱ)难溶弱电解质在水溶液中既存在溶解平衡又存在电离平衡.
已知Cu(OH)2═Cu2++2OH﹣,KSP=c(Cu2+)•2=2×l0﹣20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
(1)某CuSO4溶液里c(Cu2+)=0.02mol•L﹣1,如要生成Cu(OH)2沉淀,应调整沉淀pH使之大于.
(2)要使0.2mol•L﹣1CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液,使溶液PH为.
查看答案和解析>>
科目:高中化学 来源: 题型:
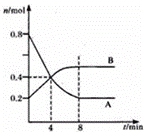
某温度时,在2L容器中,某一反应中A、B的物质的量随时间变化的曲线如图所示,由图中数据分析得:
(1)在4min末时,A、B的物质的量浓度c(A) c(B),从0~4min内A、B的物质的量浓度变化量△c(A) △c(B)(以上填“>”“<”或“=”).
(2)从反应开始至4min时,A的平均反应速率为 .
(3)该反应的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com