
 2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.请回答下列问题.
2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.请回答下列问题.分析 (1)A、C分别表示反应物总能量的生成物总能量,B为活化能,活化能的大小与反应热无关;
(2)根据参加反应SO2的物质的量之比等于对应的△H之比.
解答 解:(1)纵坐标为能量,横坐标为反应的时间,A为反应物总能量,B为中间态能量(活化分子能量),C为产物总能量.反应热(△H)只和A、B间的能量差有关,和E的大小无关,
故答案为:反应物能量;生成物能量;无;
(2)因为,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,
S(s)+$\frac{3}{2}$O2(g)=SO3(g)△H=-395kJ•mol-1,
所以,SO2(g)+$\frac{1}{2}$O2(g)=SO3(g)△H=-99kJ•mol-1,
2SO2(g)+O2(g)=2SO3(g)△H=-198kJ•mol-1.
故答案为:-198.
点评 本题考查反应过程的能量变化图以及运用盖斯定律进行反应热的计算,难度不大,注意活化能与反应热的关系.


科目:高中化学 来源: 题型:选择题
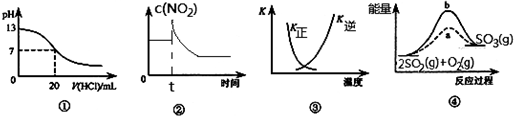
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定10 mL 0.05 mol•L-1 Ba(OH)2溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②表示充有NO2的恒温密闭容器在t时刻增大压强时,c(NO2)随时间的变化 | |
| C. | 图③中曲线表示反应N2 (g)+3 H2(g)═2NH3(g)△H<0,正、逆反应的平衡常数K随温度的变化 | |
| D. | 图④中a、b曲线分别表示反应2SO2(g)+O2(g)═2SO3(g)△H<0使用(a)和未使用(b)催化剂时,应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯制备环己烷 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 铜和浓硝酸为原料生产硝酸铜 | D. | 苯与硝酸反成制备硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可以含有共价键,但共价化合物中一定不含离子键 | |
| B. | 气态单质分子中一定存在共价键 | |
| C. | 氢元素即可与氯元素形成共价键也可与钠元素形成离子键 | |
| D. | 金属元素和非金属元素形成的化合物不一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系).
(重)某同学做元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验步骤”与“实验现象”前后不一定是对应关系). | 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾,再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发生“嘶嘶”声,随之消失,溶液变成红色 |
| ②向新制的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变为浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应开始不十分剧烈,产生无色气体 |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶装沉淀,继而沉淀消失 |
| ⑥向AlCl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀 |
| 实验内容 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填1-F) | B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2可通过化合反应一步制得 | |
| B. | 不能用稀盐酸区别二氧化锰、氧化铜、还原铁粉三种黑色粉末 | |
| C. | 采用将MgSO4溶液直接蒸干的方法不能制备MgSO4固体 | |
| D. | 可通过电解熔融MgCl2来制取Mg,故也可通过电解熔融的AlCl3来制取Al |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )
肉桂酸甲酯(属于脂类,代号M)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的使用香精.测得其相对分子质量为162,分子中C、H、O原子个数比为5:5:1,且分子中只含有1个苯环,苯环上只有一个取代基.现测出M的核磁共振氢谱谱图有6个峰,其面积之比为1:2:2:1:1:3.下列说法不正确的是( )| A. | M的分子式为C10H10O2 | |
| B. | 1mol的M最多能被4molH2还原 | |
| C. | 如图可表示M的其中一种同分异构体的比例模型 | |
| D. | 与M含有相同官能团,且苯环上氢的化学环境只有两种的同分异构体有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的年产量通常用来衡量一个国家的石油化工发展水平 | |
| B. | 煤的干馏属于物理变化 | |
| C. | 石油裂化的主要目的是除去石油中的杂质 | |
| D. | 压缩天然气和液化石油气的主要成分均为一氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com