
分析 (1)氯化铁为强酸弱碱盐,水解呈酸性,生成氢氧化铁和盐酸,加入酸会抑制氯化铁水解;
(2)氯化铝溶液中铝离子水解生成氢氧化铝和盐酸,溶液显酸性,水解过程为吸热反应,加热促进水解,蒸干得到水解产物,灼烧时生成的氢氧化铝分解生成氧化铝,硫酸铝溶液中铝离子水解,反应生成硫酸和氢氧化铝,水解过程为吸热反应,加热促进水解,蒸干是蒸发的水,最后得到硫酸铝固体;
解答 解:(1)FeCl3为强酸弱碱盐,水溶液呈酸性,原因是发生离子反应:Fe3++3H2O?Fe(OH)3+3H+,实验室配制FeCl3的水溶液时,常将FeCl3固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,以抑制其水解;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中是为了抑制铁离子水解,然后再用蒸馏水稀释到所需的浓度,
故答案为:酸,Fe3++3H2O?Fe(OH)3+3H+,抑制;
(2)氯化铝溶液中铝离子水解生成氢氧化铝和盐酸,溶液显酸性,AlCl3+3H2O?Al(OH)3+3HCl,水解过程为吸热反应,加热促进水解,蒸干HCl挥发促进水解正向进行得到水解产物Al(OH)3,灼烧时生成的氢氧化铝分解生成氧化铝,2Al(OH)3 $\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3O2↑,硫酸铝溶液中铝离子水解,反应生成硫酸和氢氧化铝,反应的化学方程式为:Al2(SO4)3;+6H2O?2Al(OH)3+3H2SO4,水解过程为吸热反应,加热促进水解,蒸干蒸发的是水,最后得到固体硫酸铝,
故答案为:Al2O3,Al2(SO4)3;
点评 本题考查了盐类水解的应用等知识点,为高频考点,侧重于学生的分析能力和基本理论知识的综合理解和运用的考查,注意把握水解的原理、影响因素和盐类溶液蒸干得到的固体成分分析,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 浓硫酸的脱水性是化学性质 | |
| B. | 使铁、铝钝化表现了强氧化性 | |
| C. | 制备乙酸乙酯的反应中起催化脱水作用 | |
| D. | 与氯化钠固体共热制氯化氢气体时,表现强酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
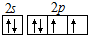 .
.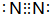 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
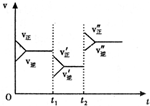
| A. | t1时若是降温使速率变化,则正确反应是放热反应 | |
| B. | t2时若是加压使速度变化,则A、B、C、D均为气体 | |
| C. | t2时改变的条件可能是加入催化剂 | |
| D. | t2时改变的条件可能是增大反应物的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
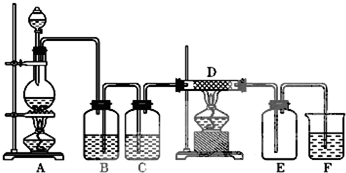
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度为0.1 mol•L-1的碳酸钠溶液:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=12的氨水溶液与pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 等物质的量的氨水和盐酸混合后的溶液:c(H+)=c(OH-)+c(NH3•H2O) | |
| D. | 醋酸溶液与NaOH溶液相混合后,所得溶液呈中性:c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2漂白纸浆 | B. | 纯碱清洗油污 | ||
| C. | Na2S除污水中的Cu2+ | D. | 漂白粉漂白织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
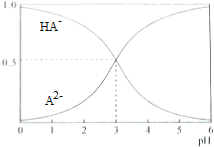
| A. | pH=5时,c(HA-)>c(A2-)>c(H+)>c(OH-) | |
| B. | 在Na2A溶液中存在c(Na+)=2c(A2-)+2c(HA-) | |
| C. | 等物质的量浓度的NaHA和Na2A混合溶液中,c(Na+)>c(A2-)>c(HA-) | |
| D. | 电离平衡HA-?A2-+H+的平衡常数Ka=10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 色态 | 溶于碱 | 超过1kPa受热 或遇光 | |
| 常温气体 | -59-11℃红黄色液体 | 生成亚氯酸盐和氯酸盐 | 爆炸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com