
【题目】大气中的氮氧化物![]() 、
、![]() 、
、![]() 等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
等的含量高低是衡量空气质量优劣的重要指标,对其研究和综合治理具有重要意义。
![]() 汽车发动机工作时会引发反应:
汽车发动机工作时会引发反应:![]() ,
,![]() ,其能量变化示意图如下:
,其能量变化示意图如下:
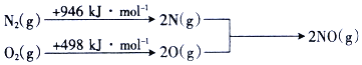
则NO中氮氧键的键能为______![]() 。
。
![]() 以碱液为电解质可实现如下转化:
以碱液为电解质可实现如下转化:![]()
![]()
![]() ,
,![]() 该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
该反应在一定条件下能自发进行的原因是______,阴极反应式为______。
![]() 将
将![]() 和
和![]() 溶于水可得到相应的酸
溶于水可得到相应的酸![]() 时,两种酸的电离平衡常数如表:
时,两种酸的电离平衡常数如表:
|
| |
|
|
|
|
|
|
①![]() 的水解平衡常数为______。
的水解平衡常数为______。
②![]() 溶液和
溶液和![]() 溶液反应的离子方程式为______。
溶液反应的离子方程式为______。
![]() 汽车尾气处理催化装置中涉及的反应之一为:
汽车尾气处理催化装置中涉及的反应之一为:![]() ,
,![]() 研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
研究表明,在使用等质量的催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某科研小组设计了以下三组实验:
实验 编号 |
| NO初始浓度 | CO初始浓度 | 催化剂比表面积 |
Ⅰ | 400 |
|
| 82 |
Ⅱ | 400 |
|
| 124 |
Ⅲ | 450 |
|
| 124 |
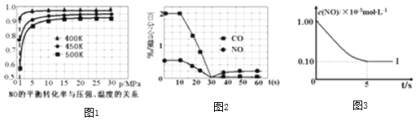
根据下列坐标图,计算前5s内用![]() 表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势
表示的反应速率为______;并在坐标图中画出上表实验Ⅱ、Ⅲ条件下,混合气体中NO浓度随时间变化的趋势![]() 标明各条曲线的实验编号
标明各条曲线的实验编号![]() 。______
。______
【答案】632 ![]() ,
,![]() ,高温下情况下满足
,高温下情况下满足![]() ,反应能自发进行
,反应能自发进行 ![]()
![]()
![]()
![]()
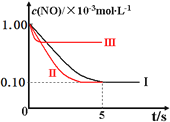
【解析】
![]() 反应物的键能总和
反应物的键能总和![]() 生成物的键能总和;
生成物的键能总和;
![]() 根据
根据![]() 来判断反应的自发性,阴极是二氧化碳得到电子发生还原反应;
来判断反应的自发性,阴极是二氧化碳得到电子发生还原反应;
![]() ①
①![]() 的水解平衡常数
的水解平衡常数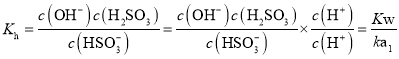 ;
;
②由表可知![]() 的二级电离小于
的二级电离小于![]() 的一级电离,则酸性强弱
的一级电离,则酸性强弱![]() ,据此书写;
,据此书写;
![]() 结合表格中的浓度,利用三段法列出400K时平衡浓度,带入平衡常数表达式计算;根据外界条件对化学反应速率和化学平衡的影响判断。
结合表格中的浓度,利用三段法列出400K时平衡浓度,带入平衡常数表达式计算;根据外界条件对化学反应速率和化学平衡的影响判断。
![]() 设NO中氮氧键的键能为x,
设NO中氮氧键的键能为x,![]() 反应物的键能总和
反应物的键能总和![]() 生成物的键能总和
生成物的键能总和![]() ,解得
,解得![]() ;
;
![]()
![]() ,
,![]() 该反应在一定条件下能自发进行的原因是:反应是一个焓增、熵增的反应,
该反应在一定条件下能自发进行的原因是:反应是一个焓增、熵增的反应,![]() ,
,![]() ,高温下情况下满足
,高温下情况下满足![]() ,反应能自发进行,阴极是二氧化碳得到电子发生还原反应,阴极反应式为:
,反应能自发进行,阴极是二氧化碳得到电子发生还原反应,阴极反应式为:![]() ;
;
![]() ①
①![]() 的水解平衡常数
的水解平衡常数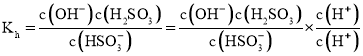
![]() ;
;
②由表可知![]() 的二级电离小于
的二级电离小于![]() 的一级电离,所以酸性强弱
的一级电离,所以酸性强弱![]() ,所以反应的主要离子方程式为
,所以反应的主要离子方程式为![]() ,而不是为
,而不是为![]() ;
;
![]() 设400K达到平衡状态时,则
设400K达到平衡状态时,则

5s内用![]() 表示的反应速率
表示的反应速率![]() ,
,
因Ⅰ、Ⅱ温度相同,初始浓度相等,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的速率大,则Ⅱ先达到化学平衡,Ⅰ、Ⅱ达平衡时NO的浓度相同,而Ⅲ的温度高,则反应速率最大且平衡逆移,即达到化学平衡时![]() 增大,实验Ⅱ、Ⅲ条件下混合气体中NO浓度随时间变化的趋势曲线图为
增大,实验Ⅱ、Ⅲ条件下混合气体中NO浓度随时间变化的趋势曲线图为 ;
;


科目:高中化学 来源: 题型:
【题目】Mn2O3是一种重要的工业原料,在电磁和有机合成等领域应用广泛。某学习小组在实验室用CH4还原MnO2制备Mn2O3,并测定产品纯度。请回答下列问题:
Ⅰ.制备(实验装置如图所示)

已知:Al4C3+12H2O==4Al(OH)3+3CH4↑。
(1)仪器a的名称为______________________
(2)连接好实验装置,检验装置的气密性并加入相应试剂。向烧瓶中滴加稀醋酸之后,在点燃酒精灯之前应进行的操作是____
(3)仪器b中同时生成两种能参与大气循环的物质,该反应的化学方程式为_______
Ⅱ.测定产品中Mn2O3的纯度(只考虑产品中混有少量未参与反应的MnO2)
ⅰ.实验结束后,取仪器b中所得固体7.19g,加入足量硫酸酸化的KI溶液,使固体中锰元素全部转化为Mn2+;(步骤ⅰ中发生反应的离子方程式为:Mn2O3+2I- +6H+==2Mn2++ I2+ 3H2O MnO2+2I- + 4H+==Mn2++ I2+ 2H2O )
ⅱ.将所得溶液稀释至500mL;
ⅲ.取25.00mL稀释后的溶液,滴加几滴淀粉溶液,用0.200molL-1的Na2S2O3标准溶液滴定,达到滴定终点时,消耗25.00mLNa2S2O3标准溶液。
(已知:I2+2 Na2S2O3==Na2S4O6+2NaI)
(4)滴定终点的标志是__________________________
(5)所取固体中Mn2O3的质量分数为___________________(计算结果精确到0.1%)
(6)下列操作使测定结果偏高的是______________
A.滴定前平视,滴定终点俯视读数
B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗
C.硫酸酸化的KI溶液在空气中静置时间过长
D.滴定前正常,滴定后滴定管尖嘴内有气泡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下表所示:
初始 | 2 min | 4 min | 6 min | |
c (A)(mol/L) | 1.45 | 1.28 | 1.00 | 1.00 |
c (B)(mol/L) | 0.38 | 0.72 | 1.28 | 1.28 |
c (C)(mol/L) | 0.095 | 0.18 | 0.32 | 0.32 |
下列说法正确的是( )
A.该反应的化学方程式为A = 2B+C
B.4 min末A的转化率约为31%
C.4~6min时,反应停止了
D.正反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图图示与对应的叙述相符的是![]()

A.图甲表示在恒容密闭容器中,恒温条件下发生的可逆反应![]() ,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
B.图乙曲线表示反应![]() ,正、逆反应的平衡常数K随温度的变化
,正、逆反应的平衡常数K随温度的变化
C.图丙表示对反应![]() 在
在![]() 时刻增大压强
时刻增大压强
D.图丁表示反应![]() :
:![]() ;
;![]() ;
;![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,一定条件下发生反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
2Z(g) ΔH<0。改变条件达到新平衡后,下列正确的是( )
A. 升高温度,X的体积分数减小
B. 增大压强(缩小容器体积),Z的浓度不变
C. 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变
D. 保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)在室温下,等体积、等浓度的氢氧化钠与醋酸混合后溶液呈__性,溶液中c(Na+)__c(CH3COO-)(填“>”“=”或“<”);pH=13的氢氧化钠与pH=1的醋酸等体积混合后溶液呈__性,溶液中c(Na+)___c(CH3COO-)(填“>”“=”或“<”);
(2)下列溶液,①0.1mol/L HCl溶液②0.1mol/L H2SO4溶液③0.1mol/L NaOH溶液④0.1mol/L CH3COOH溶液,按pH由小到大顺序为______________。
(3)CuSO4的水溶液呈酸性的原因是(用离子方程式表示):____;实验室在配制CuSO4的溶液时,常将CuSO4固体先溶于较浓的硫酸中,然后再用蒸馏水稀释到所需的浓度,以___(填“促进”、“抑制”)其水解。
(4)已知:难溶电解质Cu(OH)2在常温下的KSP=2×10-20,则常温下:某CuSO4溶液中c(Cu2+)=0.02molL-1,如要生成Cu(OH)2沉淀,应调整溶液的pH最小为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3是制造有机磷农药和磺胺嘧啶类医药的原料,其制备方法是将熔融黄磷(P4)与干燥氯气进行氯化反应。
(1) PCl3遇水会强烈水解,写出PCl3与水反应的化学方程式:________。
(2) 制得的PCl3粗产品中常含有POCl3、PCl5等杂质。通过实验测定粗产品中PCl3的质量分数,实验步骤如下(不考虑杂质的反应):
a. 迅速移取20.00 g PCl3粗产品,加水完全水解后,再配成500.00 mL溶液;
b. 量取所配溶液25.00 mL于碘量瓶中,加入0.500 0 mol·L-1碘溶液20.00 mL和1.000 mol·L-1(NH4)3BO3溶液30.00 mL,振荡;
c. 加入2~3滴淀粉溶液,用1.000 0 mol·L-1 Na2S2O3标准溶液滴定过量的碘,滴至终点时消耗Na2S2O3标准溶液12.00 mL。
已知测定过程中的部分反应为H3PO3+H2O+I2![]() H3PO4+2HI,3HI+(NH4)3BO3===3NH4I+H3BO3,I2+Na2S2O3―→Na2S4O6+NaI(未配平)。
H3PO4+2HI,3HI+(NH4)3BO3===3NH4I+H3BO3,I2+Na2S2O3―→Na2S4O6+NaI(未配平)。
①步骤b中加入(NH4)3BO3溶液的目的是________。
②判断步骤c中滴定终点的方法为________。
③根据上述数据,计算制得粗产品中PCl3的质量分数(写出计算过程)。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铝(Al2O3) 和氮化硅(Si3N4)是优良的高温结构陶瓷,在工业生产和科技领域有重要用途。
(1)Al与NaOH溶液反应的离子方程式为_____________________________________。
(2)下列实验能比较镁和铝的金属性强弱的是____________(填序号)。
a.测定镁和铝的导电性强弱
b.测定等物质的量浓度的Al2(SO4)3和MgSO4溶液的pH
c.向0.1 mol/L AlCl3和0.1 mol/L MgCl2中加过量NaOH溶液
(3)铝热法是常用的金属冶炼方法之一。
已知:4Al (s)+3O2(g) =2Al2O3(s) ΔH1 = -3352 kJ/mol
Mn(s)+ O2(g) =MnO2 (s) ΔH2 = -521 kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是_____________________________。
(4)工业上用化学气相沉积法制备氮化硅,其反应如下:
3SiCl4(g) + 2N2(g) + 6H2(g) ![]() Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0
某温度和压强条件下,分别将0.3mol SiCl4(g)、0.2mol N2(g)、0.6mol H2(g)充入2L密闭容器内,进行上述反应,5min达到平衡状态,所得Si3N4(s)的质量是5.60g。
①H2的平均反应速率是_________ mol/(L·min)。
②若按n(SiCl4) : n(N2) : n(H2) = 3 : 2 : 6的投料配比,向上述容器不断扩大加料,SiCl4(g)的转化率应______(填“增大”、“减小”或“不变”)。
(5)298K时,Ksp[Ce(OH)4]=1×10—29。Ce(OH)4的溶度积表达式为Ksp=_______________。
为了使溶液中Ce4+沉淀完全,即残留在溶液中的c(Ce4+)小于1×10-5mol·L-1,需调节pH为______以上。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com