
| A. | 相同 | B. | 磁铁矿石高 | C. | 赤铁矿石高 | D. | 无法比较 |
分析 设矿石均为100g,含Fe3O470%的磁铁矿石中四氧化三铁为70g,含Fe2O380%的赤铁矿石中氧化铁的质量为80g,结合Fe元素的含量计算.
解答 解:设矿石均为100g,含Fe3O470%的磁铁矿石中四氧化三铁为70g,含Fe的质量为70g×$\frac{56×3}{56×3+16×4}$×100%=20.52g,
含Fe2O380%的赤铁矿石中氧化铁的质量为80g,含Fe的质量为80g×$\frac{56×2}{56×2+16×3}$×100%=56g,
显然矿石质量相同时,赤铁矿石中的含铁百分率高,
故选C.
点评 本题考查元素质量分数的计算,为高频考点,把握化学式及元素质量分数计算方法为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 121.6 g | B. | 93.6 g | C. | 89.6 g | D. | 88.2 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

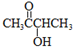 .
. CH3COO-+NH4++2Ag↓+3NH3+H2O.
CH3COO-+NH4++2Ag↓+3NH3+H2O. .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210 | -253 | -78 |
| 沸点(℃) | -195 | -259 | -33 |
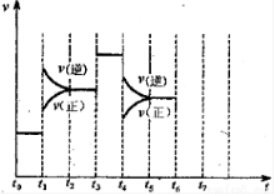
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{55}^{131}$I的化学性质与${\;}_{53}^{127}$I是相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题:
元素X、Y、Z、M、R均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4,且M原子的质子数是Y原子的2倍;R-、Z+、X+离子半径逐渐减小;化合物XR常温下为气体,请回答下列问题: .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com