
 如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.
如图所示①②③④分别是几种常见漏斗的上部,A、B、C、D是实际操作应用时,各漏斗的下部插入容器中的示意图.请指出A、B、C、D分别与①②③④相匹配的可能组合:A与③; B与②④(或①②④);C与①; D与④.  全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
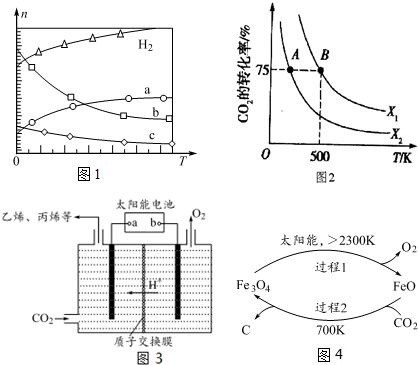
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度/(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度/(mol/L) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol/(L•min) | |
| B. | 升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大 | |
| C. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
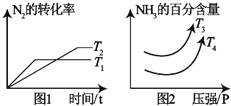 硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:
硝酸工业是国民经济的命脉产业,工业制硝酸通常是如下过程:| 化学键 | N≡N | H-H | N-H |
| 键能/kJ/mol | a | b | c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.7 mol/(L.min) | B. | v(B)=0.3mol/(L.min) | ||
| C. | v(C)=0.9 mol/(L.min) | D. | v(D)=1.1mol/(L.min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com