
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
分析 ①根据需要加热才能发生的反应不一定是吸热反应;
②根据有些放热反应在加热条件下才能发生;
③化学反应中生成物总能量不等于反应物的总能量,反应前后的能量差值为化学反应中的能量变化;
④根据化学反应中发生能量变化的主要原因是化学键的断裂和形成;
解答 解:①因需要加热才能发生的反应不一定是吸热反应,如铝热反应需要加热才能发生,但它是放热反应,故错误;
②因铝热反应是放热反应,需要加热才能发生,故错误;
③放热反应是指:反应物所具有的总能量高于生成的总能量,在反应中会有一部分能量转变为热能的形式释放,反之,就是吸热反应,故正确;
④因化学反应中发生能量变化的主要原因是化学键的断裂和形成,故正确;
故选D.
点评 本题主要考查了吸热反应和放热反应,需要注意的是放热反应与吸热反应与反应的条件无关.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:解答题
 向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.
向Al2(SO4)3和MgSO4的混合溶液中,加入NaOH溶液时,其沉淀的质量W和加入NaOH体积V之间的关系如图所示.则混合溶液中Al2(SO4)3和MgSO4的物质的量之比为1:2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 | 1、将一小块金属钠放入滴有酚酞溶液的冷水中. 2、将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液. 3、将一小段镁带投入稀盐酸中. 4、将一小片铝投入稀盐酸中. |
| 实验 现象 | ①剧烈反应,迅速生成大量的气体. ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红. ③反应不剧烈,产生无色气体. ④有气体产生,溶液变成红色. |
| 实验 | 1 | 2 | 3 | 4 |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
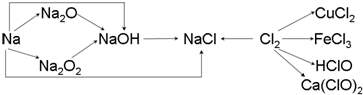
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它只有一种氧化物Cs2O | B. | 它与水剧烈反应 | ||
| C. | Cs+具有很强的氧化性 | D. | CsHCO3受热不易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取8g NaOH固体放入烧杯中,加入100 mL蒸馏水,并不断搅拌至固体溶解 | |
| B. | 称取8g NaOH固体,放入100 mL容量瓶中,加入蒸馏水使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀 | |
| C. | 称取8 g NaOH固体,放入100 mL量筒中,加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL | |
| D. | 称取8g NaOH固体放入烧杯中,加入适量蒸馏水溶解,冷却后将烧杯中溶液注入100 mL容量瓶后,用少量蒸馏水洗涤烧杯内壁2~3次 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质在化学反应中表现出强还原性 | |
| B. | Li 在氧气中燃烧主要生成Li2O2 | |
| C. | 碱金属离子的氧化性随着离子半径的增大而减小 | |
| D. | 随核电荷数的增加,单质与水反应剧烈程度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com