
(13分)亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):
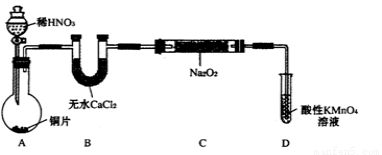
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为 。
(2)如果没有B装置,C中发生的副反应有 。
(3)甲同学检查完装置气密性良好后进行实验,发现NaNO2的纯度较低。乙同学对上述装置进行适当改进后提高了NaNO2的纯度,其改进措施是 。
(4)丙同学对B中的药品进行了更换,也提高了NaNO2的纯度。丙更换的药品最好是 。
【实验Ⅱ】测定甲、乙同学制取的样品中NaNO2的含量
步骤:a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:
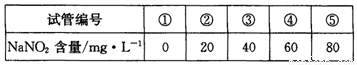
b.分别称量0.10 g甲、乙制得的样品溶于水配成500 mL溶液,贴上标签甲、乙。再分离别取5 mL甲、乙待测液,各加入1 mL M溶液,均加蒸馏水至10 mL振荡,分别与标准色阶比较。
(5)步骤b中比较结果是:甲待测液颜色与③号色阶相同,乙待测液颜色与④号色阶相同。则甲同学制得的样品中NaN02的纯度是 %。
(6)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。

科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期一模理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.t℃时,某溶液的pH=6,则该溶液一定为酸性
B.常温下,将pH=11的氨水稀释后,溶液中所有离子的浓度均降低
C.常温下,将pH=11的NaOH溶液和pH=3的CH3COOH溶液等体积混合后,溶液的pH<7
D.常温下,物质的量浓度和体积相同的K2CO3、K2SO4、HC1溶液混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三4月过程性检测理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸
B.Na2O2、NH4C1、MgCl2均属于含有共价键的离子化合物
C.乙烯和氯乙烯都可以通过聚合反应得到高分子材料
D.玻璃、水泥和光导纤维的主要成分都是硅酸盐
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高三上学期第五次模拟考试理综化学试卷(解析版) 题型:简答题
(13分)运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ/mol。在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
N2(g)+CO2(g) △H=Q kJ/mol。在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
①0~10min内,NO的平均反应速率v(NO)=______,T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是______(填字母编号)。
a.通入一定量的NO b.加入一定量的活性炭
c.加入合适的催化剂 d.适当缩小容器的体积
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q______0(填“>”或“<”)。
④在恒容条件下,能判断该反应一定达到化学平衡状态的依据是______(填选项编号)。
a.单位时间内生成2nmol NO(g)的同时消耗nmol CO2(g)
b.混合气体的平均相对分子质量不再发生改变
c.混合气体的密度不再发生改变
d.反应体系的压强不再发生改变
(2)某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应:
NO+CO N2+CO2(有CO) 2NO
N2+CO2(有CO) 2NO N2+O2(无CO)
N2+O2(无CO)
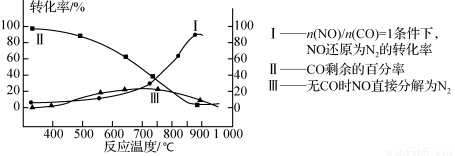
①若不使用CO,温度超过775 ℃,发现NO的分解率降低,其可能的原因为 ;在n(NO)/n(CO)=1的条件下,应控制最佳温度在 左右。
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染。写出C2H6与NO2发生反应的化学方程式 。
(3)以NO2、O2、熔融NaNO3组成的燃料电池装置如下图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为 。
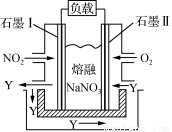
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高三上学期第五次模拟考试理综化学试卷(解析版) 题型:选择题
分子式为C5H10O2的羧酸和酯,且有3个甲基的同分异构体共有(不考虑立体异构)
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三5月一模化学试卷(解析版) 题型:选择题
洋蓟素是一种新结构类型的抗乙型肝炎病毒和抗艾滋病病毒的化合物,其结构如图所示,有关洋蓟素的说法正确的是
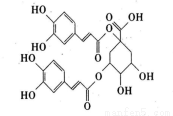
A.洋蓟素的化学式为C25H22O12
B.—定条件下能发生酯化和消去反应
C.1mol洋蓟素最少可有14mol原子共平面
D.1 mol洋蓟素最多可消耗9mol NaOH和6mol Br2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:简答题
(13分)某条件下,在2 L密闭容器中发生如下反应:2NO2(g) 2NO(g)+O2(g)
2NO(g)+O2(g)
在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800 ℃,实验Ⅲ在850 ℃,NO、O2的起始浓度都为0,NO2的浓度(mol·L-1)随时间(min)的变化如图所示。请回答下列问题:
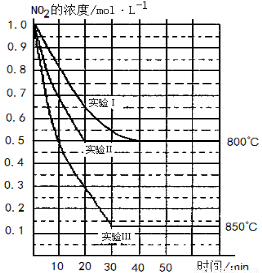
(1)实验Ⅱ隐含的反应条件是 。
(2)实验II中,从反应开始至达到平衡,用氧气浓度变化表示的化学反应速率为 。
(3)800 ℃时,该反应的平衡常数K= ,该反应是 (填“吸” 或“ 放”)热反应。
(4)若实验Ⅰ中达到平衡后,再向密闭容器中通入2 mol由物质的量之比为1:1组成的NO2与O2混合气体(保持温度不变),此时反应将向 进行(填“正反应方向”或“逆反应方向”)。
(5)NO2、NO是重要的大气污染物,近年来人们利用NH3在一定条件下与之反应而将其转化为无害的参与大气循环的物质,
如:8NH3+6NO2 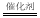 7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
7N2+12H2O。若将此反应设计成原电池,融熔K2CO3为电解质,则正极反应方程式为: 。
(6)向AlCl3溶液中逐滴加入氨水,发生如下反应Al3++3NH3·H2O Al(OH)3↓+3NH4+ ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH=4.7 ,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。
Al(OH)3↓+3NH4+ ,一般认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时,沉淀已完全。已知当溶液中Al3+恰好沉淀完全时溶液的pH=4.7 ,则Al(OH)3的溶度积常数为 (已知:lg2=0.3)。














查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省等高三下学期期中四校联考化学试卷(解析版) 题型:选择题
中学阶级介绍的电解原理的应用主要有三种:一是氯碱工业、二是电解精炼铜、三是电解冶金。下列关于这三个工业生产的描述中正确的是
A.电解精炼铜时,负极反应式:Cu2++2e-=Cu
B.氯碱工业和电解精炼铜中,阳极都是氯离子放电放出氯气
C.在氯碱工业中,电解池中的阴极产生的是H2, NaOH在阳极附近产生
D.电解精炼铜时,应用粗铜作阳极、精铜作阴极,可溶性铜盐作电解质溶液
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省哈尔滨市高三二模考试理综化学试卷(解析版) 题型:选择题
下列实验操作或叙述正确的是
A.通过导电实验证明氢氧化铁胶体带正电
B.除去苯中溶有的少量乙醇,加入水,振荡,然后分液
C.进行蒸馏操作时.应用温度计准确测量沸腾液体的温度
D.从海带中提取碘时用到的药品有双氧水和NaOH溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com