
分析 (2)铝与盐酸应生成氯化铝、Mg与盐酸反应生成氯化镁,单质硅和铜不能够和稀盐酸发生反应,留在了滤渣中;
(3)剩余的盐酸与氢氧化钠反应生成氯化钠与水,氯化镁与氢氧化钠反应生成氢氧化镁沉淀与氯化钠,氯化铝与过量的氢氧化钠反应生成偏铝酸钠与氯化钠;
(4)过量二氧化碳与偏铝酸钠容易反应生成氢氧化铝沉淀与碳酸氢钠;
(5)所得沉淀为氢氧化铝,加热分解得到氧化铝与水;氧化铝中Al元素质量即为合金中Al的质量,进而计算Al的质量分数;
(6)氢氧化钠溶液不足,生成的氢氧化铝沉淀减少,测定结果偏低;没有洗涤沉淀,导致沉淀的质量偏大,测定生成的氧化铝质量偏大,测定结果偏高.
解答 解:(2)铝与盐酸应生成氯化铝、Mg与盐酸反应生成氯化镁,过滤,滤液中主要含有Al3+、Mg2+、Cl-、H+,单质硅和铜不能够和稀盐酸发生反应,留在了滤渣中,
故答案为:Al3+、Mg2+、Cl-、H+;Cu、Si;
(3)剩余的盐酸与氢氧化钠反应生成氯化钠与水,氯化镁与氢氧化钠反应生成氢氧化镁沉淀与氯化钠,氯化铝与过量的氢氧化钠反应生成偏铝酸钠与氯化钠,有关离子方程式为:H++OH-═H2O、Al3++4 OH-═AlO2-+2 H2O、Mg2++2 OH-═Mg(OH)2↓,
故答案为:H++OH-═H2O、Al3++4 OH-═AlO2-+2 H2O、Mg2++2 OH-═Mg(OH)2↓;
(4)过量二氧化碳与偏铝酸钠容易反应生成氢氧化铝沉淀与碳酸氢钠,反应离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
(5)所得沉淀为氢氧化铝,加热分解得到氧化铝与水,反应方程式为:2Al(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Al2O3+3 H2O,
氧化铝中铝的质量为bg×$\frac{54}{102}$=$\frac{9b}{17}$g,
即为ag合金中Al的质量为$\frac{9b}{17}$g,
故合金中Al的质量分数=$\frac{\frac{9b}{17}g}{ag}$×100%=$\frac{9b}{17a}$,
故答案为:$\frac{9b}{17a}$×100%;
(6)氢氧化钠溶液不足,生成的氢氧化铝沉淀减少,测定结果偏低;
没有洗涤沉淀,导致沉淀的质量偏大,测定生成的氧化铝质量偏大,测定结果偏高,
故答案为:低;高.
点评 本题考查物质含量的测定,清楚实验原理是解题的关键,是对所学知识的综合运用,需要学生具备扎实的基础与运用知识分析问题解决问题的能力.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:解答题
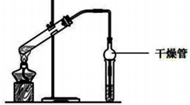 (1)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业实验室用如图的装置制备乙酸乙酯.
(1)乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业实验室用如图的装置制备乙酸乙酯.| 物质 | 熔点/℃ | 沸点/℃ | 密度/(g/cm3) |
| 乙醇 | -144 | 78 | 0.789 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | -- | 338 | 1.84 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌锰干电池电极总反应为:Zn+2MnO2+2NH4Cl=Mn2O3+ZnCl2+2NH3+H2O,则正极反应为:2MnO2+2H++2e-=Mn2O3+H2O | |
| B. | 将1mol过氧化钠投入含有1molAlCl3的溶液中:6Na2O2+6H2O+4Al3+=4Al(OH)3↓+3O2↑+12Na+ | |
| C. | NaHSO4溶液中加入Ba(OH)2溶液至溶液呈中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20 H++5NO3-=3Fe2++3Fe3++5NO↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰石溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| B. | Na2C03溶液显碱性:C032-+H2O═HCO3-+OH- | |
| C. | 过量铁屑溶于稀硝酸:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| D. | FeI2溶液中通入少量氯气:2Fe2++C12═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,电子由负极通过外电路流向正极 | |
| B. | 标准状况下,反应3.36L氢气,转移电子0.2mol | |
| C. | 氢氧燃料电池能量利用率不等同于氢气直接燃烧的能量利用率 | |
| D. | 产物为无污染的水,属于环境友好电池 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com