
| A. | 在铁片上镀锌,铁片与电源的正极相连 | |
| B. | 合成氨工业中,降温使NH3液化,可以加快反应速率 | |
| C. | 向氨水中不断通入CO2,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断增大 | |
| D. | 工业生产硫酸时,使用热交换器可以提高能量的利用率与原料的转化率 |
分析 A.电镀时,镀层金属为阳极,待镀金属作阴极;
B.降温减慢反应速率;
C.向氨水中不断通入CO2,促进一水合氨的电离,铵根离子的浓度增大,而电离平衡常数不变,由此分析解答;
D.使用热交换器,目的是将二氧化硫与氧气转化成三氧化硫,放出的热量是用来预热没反应的二氧化硫与氧气的混合气体.
解答 解:A.电镀时,镀层金属为阳极,待镀金属作阴极,则在铁片上镀锌,铁片与电源的负极相连,故A错误;
B.降温减慢反应速率,故B错误;
C.向氨水中不断通入CO2,促进一水合氨的电离,铵根离子的浓度增大,而电离平衡常数K=$\frac{c(NH{\;}_{4}{\;}^{+})c(OH{\;}^{-})}{c(NH{\;}_{3}•{H}_{2}O)}$不变,所以$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,故C错误;
D.使用热交换器,目的是将二氧化硫与氧气转化成三氧化硫,放出的热量是用来预热没反应的二氧化硫与氧气的混合气体,所以可以提高能量的利用率与原料的转化率,故D正确.
故选D.
点评 本题是一道关于化学和化工知识结合的实际应用方面的考题,注重化学联系实际,难度不大,注意C选项,结合平衡常数进行判断.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向苏打和小苏打溶液中分别加入盐酸 | 均冒气泡 | 两者均不能与盐酸反应 |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3H2O能大量共存 |
| C | 将可调高度的铜丝伸入到稀NHO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L H2O 所含分子数为 0.5N A | |
| B. | 标准状况下,足量的 Fe 与 2.24 L Cl2 反应转移电子的数目为 0.3N A | |
| C. | 1mol•L-1CaCl 溶液中所含 Ca2+离子的数目为 NA | |
| D. | 通常状况下,32g O2和 O3的混合物所含的氧原子数一定为 2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
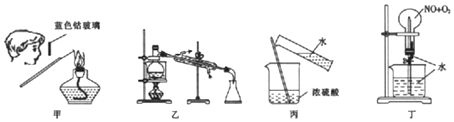
| A. | 通过图甲操作进行钾元索的焰色反应实验 | |
| B. | .用图乙装置制取蒸馏水 | |
| C. | 通过图丙操作将浓硫酸稀释为稀硫酸 | |
| D. | .用图丁装里进行喷泉实验,其中n(NO):n(O2)=4:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) | |
| B. | Y 分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X 的最高价氧化物对应的水化物的酸性比W 的弱 | |
| D. | Y 的气态简单氢化物的热稳定性比W 的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 现象 | 解释 | |
| A | 铝箔插入稀HNO3中,无现象 | 铝箔表面被HNO3氧化,形成致密的氧化膜 |
| B | 苯酚中滴加浓溴水,溶液酸性明显增强 | 可能发生了取代反应 |
| C | 某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 不能说明该溶液中一定含有SO42- |
| D | 测定等浓度的Na2CO3和Na2SO3溶液的pH,前者pH比后者的大 | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数是29 | B. | 中子数是14 | C. | 电子数是14 | D. | 质量数是15 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量氨水:Fe3+、NH4+、SO42-、OH- | |
| B. | 加入过量H2O2溶液:Fe2+、H+、Cu2+、SO42- | |
| C. | 加入过量NaOH溶液:Na+、AlO2-、SO42-、OH- | |
| D. | 加入过量NaHCO3溶液:Na+、Al3+、SO42-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com