
| A.物质的沸点:HF<HCI<BBr <HI |
| B.物质的熔点:汞<冰<食盐<石英 |
C.结合H+的能力:SO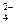 < CH3COO-<CO < CH3COO-<CO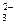 |
| D.分散系中分散质粒子的直径:FeCl3;溶液<Fe(OH3胶体<+Fe(OH3悬浊液 |
科目:高中化学 来源:不详 题型:填空题
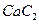 与水反应生成乙炔。
与水反应生成乙炔。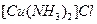 溶液生成
溶液生成 红棕色沉淀。
红棕色沉淀。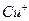 基态核外电子排布式为 。
基态核外电子排布式为 。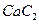 中
中 与
与 互为等电子体,
互为等电子体, 的电子式可表示为 ;1mol
的电子式可表示为 ;1mol  中含有的
中含有的 键数目为 。
键数目为 。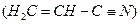 。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。
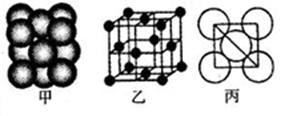
。丙烯腈分子中碳原子轨道杂化类型是 ;分子中处于同一直线上的原子数目最多为 。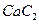 晶体的晶胞结构与
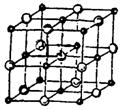
晶体的晶胞结构与 晶体的相似(如下图所示),但
晶体的相似(如下图所示),但 晶体中含有的哑铃形
晶体中含有的哑铃形 的存在,使晶胞沿一个方向拉长。
的存在,使晶胞沿一个方向拉长。 晶体中1个
晶体中1个 周围距离最近的
周围距离最近的 数目为
数目为  。
。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
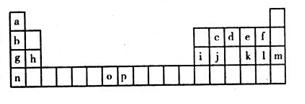
| 元素 | o | P | |
| 电离能/kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
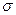 键, 个
键, 个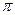 键。
键。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Li、Na、K、Rb的沸点逐渐降低 |
| B.与硅相比,金刚石的硬度大、熔点高 |
| C.HF、HCl、HBr、HI热稳定性依次减弱 |
| D.H2、O2、H2S在水中的溶解性依次为难溶、微溶、可溶 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氢气、氮气、氧气、氯气 | B.氟化氢、氯化氢、溴化氢 |
| C.锂、钠、钾、铷、铯 | D.氯化钾、溴化钾、碘化钾 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.共价化合物中不可能含阴离子 |
| B.干冰气化时破坏了化学键 |
| C.因H2O分子间存在氢键,所以H2O比H2S稳定 |
| D.C60与金刚石一样属于原子晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.热稳定性:PH3>H2S>HBr>NH3 |
| B.物质的熔点:石英>食盐>冰>汞 |
| C.结合质子的能力:CO32->CH3COO->SO42- |
| D.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCI3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com