
 (1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11 mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).
(1)某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=2.0×10-7mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中,由水电离产生的c(H+)=8×10-11 mol/L,此时温度高于25℃(填“高于”、“低于”或“等于”).分析 (1)纯水显中性,故溶液中的c(H+)=c(OH-),据此分析;若温度不变,则水的离子积不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,据此求出c(OH-)=$\frac{Kw}{c({H}^{+})}$,而由水电离出的c(H+)=c(OH-);温度越高,水的电离被促进,水的离子积数值越大;
(2)离子积常数=c(H+)•c(OH-).
解答 解:纯水显中性,即纯水中的c(H+)=c(OH-)=2.0×10-7mol/L,此温度下,水的离子积Kw=4.0×10-14;若温度不变,则水的离子积不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中的c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{4×1{0}^{-14}}{5.0×1{0}^{-4}}$=8×10-11mol/L,而在酸溶液中,所有的氢氧根全部来自于水的电离,而由水电离出的c(H+)=c(OH-),故由水电离出的c(H+)=8×10-11mol/L;25℃时,水的离子积Kw=1×10-14,而此温度下,水的离子积Kw=4.0×10-14,由于温度越高,水的电离被促进,水的离子积数值越大,故此温度高于25℃.
故答案为:2.0×10-7; 8×10-11;高于;
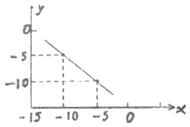
(2)根据图知,当c(H+)=10-5 mol/L,c(OH-)=10-10 mol/L,由离子积常数=c(H+).c(OH-)=10-5.10-10=10-15,故答案为:10-15 .
点评 本题考查了离子积常数的有关计算、温度对水的离子积的影响和溶液中离子浓度的计算,应注意的是由水电离出的c(H+)=c(OH-),题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 391 | B. | 194 | C. | 516 | D. | 658 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化铜与硫酸溶液反应:Cu2++2H+═Cu2++H2O | |
| B. | 碳酸钠溶液与盐酸反应:Na2CO3+2H+═2Na++H2O+CO2↑ | |
| C. | 少量CO2通入澄清石灰水中:CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | 钠投入到水中:Na+H2O═Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2S和浓H2SO4 | B. | SO2和NaHCO3溶液 | C. | Cl2和NaHCO3溶液 | D. | Cl2和氯水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 分类组合 | 碱 | 酸 | 盐 | 氧化物 |
| A | Na2CO3 | H2SO4 | NaCl | CO2 |
| B | NaOH | HCl | NaHCO3 | H2SiO3 |
| C | NaOH | H2CO3 | CaCl2 | SO2 |
| D | KOH | NaHSO4 | CaCO3 | CO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaNO2是氧化剂 | B. | NaNO2在反应中失电子 | ||
| C. | NH4Cl中的N元素被还原 | D. | N2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
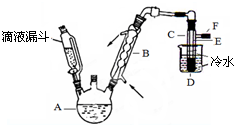 图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.
图是实验室用乙醇、硫酸、溴化钠混合反应来制备溴乙烷的装置.反应需要加热,图中省去了加热装置.乙醇、溴乙烷、溴的有关性状参数见表.| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
| 水溶性 | 易溶 | 难溶 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com