
| A. | 等物质的最浓度的H2S和NaHS混合溶液中:c(Na)+c(H+)=c(S2-)+c(HS-+c(OH-) | |
| B. | 0.2mol/LNH4C1溶液和0.1 mol/LNaOH溶液等体积混合后:c(NH4+)>c(Cl-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 常温下向20ml0.1mol/LNH4HSO4溶液中滴入同浓度的NaOH溶液至pH=7 c(Na+)>c(SO42-)c(NH4+) | |
| D. | 25℃时,pH=8 的 CH3COONa 稀溶液中,c(CH3COOH)=9.9×10-7mol/L |
分析 A.根据电荷守恒分析;
B.0.2mol/LNH4C1溶液和0.1 mol/LNaOH溶液等体积混合,溶液中溶质是等浓度的NH3•H2O、NH4C1和NaCl,结合弱电解质的电离特点分析;
C.根据电荷守恒分析;
D.pH=8的CH3COONa 稀溶液中:CH3COO-+H2O?CH3COOH+OH-,c(H+)=×10-8mol/L,根据Kw计算c(OH-),结合水的电离分析.
解答 解:A.等物质的最浓度的H2S和NaHS混合溶液中,电荷守恒:c(Na)+c(H+)=2c(S2-)+c(HS-+c(OH-),故A错误;
B.0.2mol/LNH4C1溶液和0.1 mol/LNaOH溶液等体积混合,溶液中溶质是等浓度的NH3•H2O、NH4C1和NaCl,NH3•H2O在溶液中部分电离出NH4+,则c(Cl-)>c(NH4+),所以c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+),故B错误;
C.常温下向20ml0.1mol/LNH4HSO4溶液中滴入同浓度的NaOH溶液至pH=7,溶液中电荷守恒为:c(Na+)+c(NH4+)+c(H+)=c(OH-)+2c(SO42-),由于溶液显中性,即c(H+)=c(OH-),则c(Na+)+c(NH4+)=2c(SO42-),所以c(Na+)=c(SO42-)=c(NH4+),故C错误;
D.pH=8的CH3COONa 稀溶液中:CH3COO-+H2O?CH3COOH+OH-,c(H+)=10-8mol/L,则c(OH-)=10-6mol/L,水解生成的c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7mol/L,所以水解生成的c(CH3COOH)=9.9×10-7mol/L,故D正确.
故选D.
点评 本题考查了弱电质的电离平衡、离子浓度大小比较和盐类水解的应用、电解质溶液中电荷守恒、物料守恒分析,掌握基础是解题关键,题目难度中等,侧重于考查学生对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| B. | 分子式为CH4O和C2H6O的物质一定互为同系物 | |
| C. | 2-甲基丁烷和甲苯的一溴代物都有4种 | |
| D. | 在酸性条件下,C2H5 CO18OC2H5的水解产物是C2H5 CO18OH和C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 有关问题 |
| (1)计算所需NaOH的质量 | 需要NaOH的质量为4.0g |
| (2)称量NaOH固体 | 称量过程中主要用到的仪器是 托盘天平、药匙 |
| (3)将NaOH加入100mL烧杯中,加适量蒸馏水溶解 | 为加快溶解,可采取的措施是 搅拌、加热、研细氢氧化钠等措施 |
| (4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应该采取的措施是 玻璃棒引流 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是 加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹液面与刻度线水平相切 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶内有少量蒸馏水 | |
| B. | 溶液从烧杯中转移到容量瓶时,没有洗涤烧杯 | |
| C. | 定容时观察液面时俯视定容 | |
| D. | 配溶液的Na2CO3•10H2O晶体在空气中久置风化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
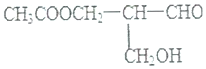
| A. | 与NaOH溶液共热 | B. | 与甲酸发生酯化反应 | ||
| C. | 与碱性Cu(OH)2悬浊液反应 | D. | 在催化剂存在下与H2作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2S |
| 电离平衡常数(25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=1.3×10-7 Ka2=7.1×10-15 |
| A. | 恰好中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| B. | HCOO-、CN-、HS-在溶液中不可以大量共存 | |
| C. | NaHS溶液中加入适量KOH后:c(Na+)═c(H2S)+c(HS-)+2C(S2-) | |
| D. | 等体积、等浓度的HCOONa和NaCN两溶液中所含离子总数目HCOONa大于NaCN |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com