
化学是一门实用性很强的学科,与社会发展的需要有密切的关系。下列说法中,不正确的是( )
A.用食醋可除去热水壶内壁的水垢
B.合成纤维和光导纤维都是新型无机非金属材料
C.酒精能使蛋白质变性,可用于杀菌消毒
D.误食可溶性重金属盐后,应采取的有效应急措施是喝大量的豆浆或牛奶
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
对于反应2SO2(g)+O2 (g) 2SO3(g),下列判断中正确的是( )
2SO3(g),下列判断中正确的是( )
A.2体积SO2和足量O2反应,生成 2体积SO3
B.恒温恒容,通入气体氦使压强增大,平衡向右移动
C.平衡时,SO2消耗速率等于O2生成速率的两倍
D.平衡时,SO2浓度等于O2浓度的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
燃烧热是指通常状况下1 mol纯物质完全燃烧生成稳定的氧化物所放出的热量。下列说法正确的是 )。
A.通常状况下,1 g氢气燃烧生成液态水时放出142.9 kJ热量,则表示氢气燃烧热的热化学方程式为2H2g)+O2g)===2H2Ol) ΔH=-571.6 kJ·mol-1
B.已知:H2g)+F2g)===2HFg) ΔH=-270 kJ·mol-1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
C.500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3g),放热19.3 kJ,其热化学方程式为N2g)+3H2g)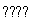 2NH3g) ΔH=-38.6 kJ·mol-1
2NH3g) ΔH=-38.6 kJ·mol-1
D.已知:①Cs,石墨)+O2g)===CO2g) ΔH=-393.5 kJ·mol-1 ②Cs,金刚石)+O2g)===CO2g) ΔH=-395.0 kJ·mol-1,则Cs,金刚石)===Cs,石墨) ΔH=-1.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D、E,已知A、B为金属,C、D、E为非金属,C是最活泼的非金属,E与C同主族,D离子半径比E离子半径大。A、B的离子与C离子电子层结构相同,其中B离子的半径最小。下列有关说法错误的是
A.含氧酸的酸性: E>D B.原子半径:A>B
C.氢化物的热稳定性:C>E D.离子结合质子能力:D>E
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钾 A是橙红色的固体,有强氧化性。①将其用浓盐酸处理产生黄绿色刺激性气味气体B和蓝紫色溶液C;②在C中加入KOH溶液,先生成灰蓝色沉淀D;③继续加入过量的KOH溶液则沉淀消失,变成绿色溶液E;④在E中加入H2O2加热则生成黄色溶液F,⑤F用稀硫酸酸化,又变成原来的化合物A的溶液。
已知:氢氧化铬在溶液中存在如下平衡:
Cr3++3OH- Cr(OH)3
Cr(OH)3 H2O+HCrO2
H2O+HCrO2 H2O +H++ CrO2-
H2O +H++ CrO2-
蓝紫色 灰蓝色 绿色
(1)根据上述平衡判断氢氧化铬具有____________(填“碱性”、“酸性”、“两性”)。
(2)写出①的离子方程式______________________________________________;
(3)已知D的溶解度为2.06×10-7g ,则D的溶度积常数为______________。
(4)写出③的离子反应方程式________________________________________
(5)④F溶液中的黄色离子是__________(写化学式);若参加反应的H2O2是5mol,则生成的黄色离子的物质的量为__________________。
(6)金属锡(Sn)是第ⅣA的元素,通过下列方法可以测定金属锡样品的纯度:
①将试样溶于盐酸中,发生的反应化学方程式为:__________________________________;
②向①的溶液中再加入过量的FeCl3溶液,发生的反应化学方程式为_________________;
③用已知浓度的A溶液滴定生成的Fe2+。现有金属锡样品wg,经上述各步反应后,用A溶液滴定,A应放在__________(填“酸式”或“碱式”)滴定管中,共用去cmol·L-1的A溶液vmL(锡的相对原子质量用M表示)。求样品中锡的质量分数为_____________(假定杂质不参加反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,下列说法正确的是( )
A.常温下,pH相等的NaOH溶液和CH3COONa溶液中由水电离产生的c(OH-)相等
B.由水电离的c(H+)=1×10-11 mol·L-1的溶液一定是碱性溶液
C.两种难溶性盐,Ksp较小的,其溶解度也一定较小
D.Na2CO3溶液和NaHCO3溶液中一定都存在:
2c(CO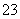 )+c(OH-)+c(HCO
)+c(OH-)+c(HCO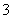 )=c(H+)+c(Na+)
)=c(H+)+c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.信息产业中的光缆的主要成分是单质硅
B.利用激光笔可以区别鸡蛋清和浓盐水
C.油脂、糖类、蛋白质都属于天然高分子化合物
D.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
查看答案和解析>>
科目:高中化学 来源: 题型:
在一容积为2 L的密闭容器中,加入0.2 mol N2和0.6 mol H2,在一定条件下发生反应:N2(g)+3H2(g)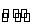 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反应中 NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
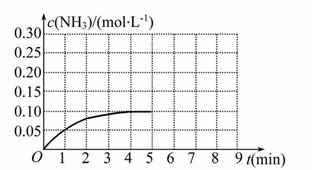
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N H3)为_________。
H3)为_________。
(2)该反应达到平衡时H2的转化率__ ______。
______。
(3)反应达到平衡后,第5分钟末,保持其他条件不变,若改变反应温度,达到新平衡时NH3的物质的量浓度不可能为___________。(填序号)
A.0.20 mol·L-1 B.0.12 mol·L-1
C.0.10 mol·L-1 D.0.08 mol·L-1
(4)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
(5)若该反应在298 K、398 K时的化学平衡常数分别为K1、K2,则K1______K2(填“>”“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com